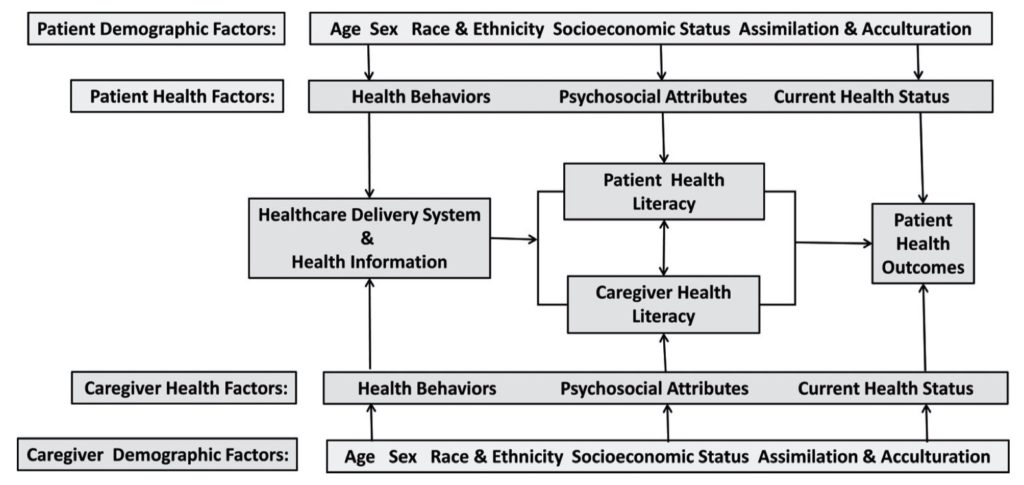
- RACCOMANDAZIONI
- SOMMARIO DEL DOCUMENTO DI CONSENSO
- ASPETTI METODOLOGICI e DEFINIZIONE DEL PROBLEMA
- ASPETTI INTRODUTTIVI
- IDENTIFICAZIONE DEL GRANDE ANZIANO CHE NECESSITA DI CURE PALLIATIVE
- GLI INTERVENTI PALLIATIVI NEL GRANDE ANZIANO
Ritorna alla scheda informativa della Conferenza di Consenso
RACCOMANDAZIONI
L’IDENTIFICAZIONE DEL GRANDE ANZIANO CHE NECESSITA DI CURE PALLIATIVE
RACCOMANDAZIONE 1: Valutare periodicamente, nell’ambito della valutazione multidimensionale geriatrica, gli indicatori nutrizionali, lo stato funzionale e la funzione cognitiva. Il progressivo peggioramento aumenta il rischio di mortalità a 12 mesi. Sono richiesti ulteriori studi per stabilire se l’utilizzo routinario di indici prognostici basati sulla valutazione multidimensionale geriatrica possa migliorare la gestione clinica della persona
RACCOMANDAZIONE 2: Utilizzare negli anziani affetti da demenza la Clinical Dementia Rating Scale e/o la Bedford Alzheimer Nursing Severity Scale (BANS-S). Il loro utilizzo migliora l’affidabilità prognostica.
RACCOMANDAZIONE 3: Utilizzare sistematicamente uno strumento di valutazione del bisogno di cure palliative. Il loro utilizzo migliora in tutti i setting l’identificazione delle persone che necessitano di un approccio palliativo.
GLI INTERVENTI PALLIATIVI NEL GRANDE ANZIANO
La discussione sulla pianificazione anticipata delle cure
RACCOMANDAZIONE 4: Discutere la pianificazione delle cure di fine vita con la persona e la sua famiglia: ciò migliora la concordanza tra le preferenze espresse e le cure ricevute.
L’assistenza infermieristica palliativa
RACCOMANDAZIONE 5a: In tutti i contesti di cura pianificare l’assistenza infermieristica palliativa considerando i bisogni e le preferenze della persona e della sua famiglia, privilegiando interventi orientati al comfort.
RACCOMANDAZIONE 5b: Aumentare le competenze dei team di cure palliative per migliorare l’individuazione dei sintomi, il loro controllo e la qualità della vita.
RACCOMANDAZIONE 5c: Garantire la continuità delle cure nelle transizioni tra servizi, strutture e luoghi di cura.
RACCOMANDAZIONE 5d:Garantire una risposta tempestiva a seguito di un repentino cambiamento dello stato clinico.
L’alimentazione e l’idratazione
RACCOMANDAZIONE 6a: Adottare una procedura decisionale che coinvolga la persona, i suoi familiari e gli operatori sanitari per iniziare/non iniziare/sospendere la nutrizione artificiale; quando la persona non fosse in grado di comunicare considerare le Disposizioni Anticipate di Trattamento, se disponibili. La procedura dovrà considerare la condizione clinica, i benefici attesi, i possibili danni, la qualità della vita, il benessere psicologico, relazionale, spirituale e sociale della persona. Sospendere la nutrizione artificiale quando non si manifesta il beneficio atteso.
RACCOMANDAZIONE 6b: Iniziare la nutrizione artificiale solo quando vi sia la ragionevole ipotesi clinica che la sopravvivenza prevista per l’evoluzione naturale della malattia sia ridotta dalla concomitante malnutrizione, secondaria all’impossibilità di assumere alimenti per via orale.
RACCOMANDAZIONE 6c: Nella persona con demenza in fase avanzata non ricorrere all’alimentazione tramite gastrostomia o digiunostomia percutanea. Tale procedura non migliora la sopravvivenza ed è associata ad un alto rischio di complicanze, a meno che non sia indicata per una condizione, che limita l’alimentazione per os, potenzialmente reversibile.
RACCOMANDAZIONE 7a: Adottare una procedura decisionale che coinvolga la persona, i suoi familiari e gli operatori sanitari per iniziare/non iniziare/sospendere l’idratazione artificiale; quando la persona non fosse in grado di comunicare considerare le Disposizioni Anticipate di Trattamento, qualora disponibili. La procedura dovrà considerare la condizione clinica, i benefici attesi, i possibili danni, la qualità della vita e il benessere psicologico e spirituale della persona.Sospendere l’idratazione artificiale quando non si manifesta il beneficio atteso.
RACCOMANDAZIONE 7b: Associare alla decisione di non iniziare o di sospendere l’idratazione la comunicazione alla persona e alla sua famiglia relativamente agli interventi che saranno implementati per ridurre il disagio associato ai sintomi disturbanti quali la sete e la secchezza delle fauci.
La valutazione del dolore nella persona non comunicante
RACCOMANDAZIONE 8a: Valutare la presenza di dolore nelle persone non comunicanti attraverso un approccio multidimensionale, osservando il comportamento durante le attività della vita quotidiana: modifiche del comportamento abituale (relazioni e attività) suggeriscono la presenza di dolore. Il caregiver o l’operatore sanitario che meglio conosce l’assistito è il più adatto a cogliere i cambiamenti del comportamento.
RACCOMANDAZIONE 8b: Adottare uno strumento osservazionale per valutare la presenza del dolore, scegliendo quello più applicabile nel contesto, considerandone l’utilità clinica.
La terapia farmacologica e gli accertamenti diagnostici
RACCOMANDAZIONE 9a: Verificare sistematicamente, di pari passo con l’evoluzione clinica, gli obiettivi delle terapie: trattamento patologia/e, terapia sostitutiva, controllo sintomi.
RACCOMANDAZIONE 9b: Effettuare periodicamente la riconciliazione terapeutica per individuare, in relazione all’evoluzione clinica, i farmaci potenzialmente inappropriati e il rischio di non aderenza.
RACCOMANDAZIONE 9c: Sottoporre il paziente anziano con limitata aspettativa di vita alle sole indagini diagnostiche utili ad identificare una condizione clinica la cui risoluzione, attraverso un intervento adeguato, possa migliorare la sintomatologia e la qualità di vita.
RACCOMANDAZIONE 10a: Trattare sempre il dolore e ogni sintomo che causa sofferenza accompagnando, quando possibile, la persona nella scelta terapeutica e rispettando la sua volontà.
RACCOMANDAZIONE 10b: Utilizzare, per il trattamento del dolore cronico nei pazienti anziani, il paracetamolo o, se non efficace, i farmaci oppioidi. Utilizzare antidepressivi e anti-convulsivanti per il trattamento del dolore neuropatico. Non utilizzare gli antinfiammatori non steroidei per il trattamento del dolore cronico nei pazienti anziani.
La gestione delle infezioni
RACCOMANDAZIONE 11a: Utilizzare sistematicamente nella pratica clinica appropriati criteri diagnostici nei diversi quadri infettivi.
RACCOMANDAZIONE 11b: Prescrivere il trattamento antibiotico nel sospetto clinico che sia l’infezione la causa di dolore, dispnea o altri sintomi, attuando in ogni caso interventi palliativi per ridurre la sofferenza della persona.
GLI INTERVENTI DI SUPPORTO ALLA FAMIGLIA
RACCOMANDAZIONE 12a: Considerare le risorse del sistema famigliare, i bisogni relazionali, emotivi e affettivi, la possibile resilienza dei singoli membri, le preoccupazioni e le aspettative dei caregiver al fine di pianificare gli interventi di supporto.
RACCOMANDAZIONE 12b: Considerare il livello di alfabetizzazione sanitaria e di istruzione dei caregiver per fornire informazioni comprensibili e utilizzabili; tuttavia nessuno strumento di valutazione dell’alfabetizzazione sanitaria tra quelli proposti in letteratura ha dimostrato di migliorare i risultati.
RACCOMANDAZIONE 12c: Valutare le potenzialità di adattamento e i fattori di rischio legati alle caratteristiche del caregiver e del sistema famigliare (burden, benessere, salute e risorse individuali, sociali, relazionali, economiche).
RACCOMANDAZIONE 12d: Pianificare interventi di sostegno al compito di cura dei caregiver.
RACCOMANDAZIONE 12e: Adottare un modello di case management affidando il compito di case manager ad un professionista con le competenze necessarie a rispondere ai bisogni espressi dalla persona e dal suo caregiver.
RACCOMANDAZIONE 12f: Promuovere la collaborazione tra professionisti sanitari e sociali per pianificare interventi integrati di supporto al caregiver.
Documento di Consenso
SOMMARIO DEL DOCUMENTO DI CONSENSO
ASPETTI METODOLOGICI e DEFINIZIONE DEL PROBLEMA
Obiettivi – Metodo – Comitato Tecnico Scientifico – Panel Giuria – Presidenti della Conferenza di Consenso – Moderatori della Conferenza di Consenso – Dichiarazione conflitto di interesse – Supporto incondizionato
Grande anziano: definizione – Il vissuto odierno del morire – Desideri e preferenze nel grande anziano con limitata attesa di vita: comunicazione della prognosi e pianificazione delle cure – Cambio di paradigma: gestione dei sintomi e qualità della vita – Bibliografia
IDENTIFICAZIONE DEL GRANDE ANZIANO CHE NECESSITA DI CURE PALLIATIVE
Razionale – Quesito 1: Quali indicatori identificano la prognosi e il bisogno di cure palliative nel grande anziano? – Quesito 2: L’utilizzo degli indici prognostici di mortalità migliora l’affidabilità prognostica nel grande anziano? – Quesito 3: Gli strumenti di valutazione del bisogno di cure palliative sono affidabili nell’identificare il bisogno di cure palliative nel grande anziano? – Bibliografia
GLI INTERVENTI PALLIATIVI NEL GRANDE ANZIANO
La discussione sulla pianificazione anticipata delle cure
Razionale – Quesito 4: La discussione sul fine vita e la pianificazione anticipata delle cure migliorano la concordanza tra le preferenze della persona e le cure di fine vita ricevute ? – Assistenza infermieristica palliativa – Quesito 5: Quali modelli di assistenza palliativa si correlano ad esiti migliori? – Bibliografia
L’alimentazione e l’idratazione
Razionale – Quesito 6: Quali sono i criteri per iniziare, non iniziare o sospendere la nutrizione artificiale? – Quesito 7: Quali sono i criteri per iniziare, non iniziare o sospendere l’idratazione artificiale? – Bibliografia
La valutazione del dolore nella persona non comunicante
Razionale – Quesito 8: Per valutare la presenza di dolore in una persona non in grado di comunicare è efficace l’adozione di uno strumento oggettivo di valutazione del dolore? – Bibliografia
La terapia farmacologica e gli accertamenti diagnostici
Razionale – Quesito 9: Quali farmaci e quali accertamenti diagnostici sono considerati potenzialmente inappropriati nei pazienti anziani con limitata aspettativa di vita? – Quesito 10: Quali farmaci utilizzare per il trattamento del dolore nel grande anziano?– Bibliografia
Razionale – Quesito 11: È appropriata la terapia antibiotica nell’anziano con aspettativa di vita limitata?– Bibliografia
GLI INTERVENTI DI SUPPORTO ALLA FAMIGLIA
Razionale – Quesito 12: Quali interventi di supporto al caregiving sono efficaci? – Valutare il sistema famigliare – Valutare l’alfabetizzazione sanitaria nei caregiver informali – Valutare il burden del caregiving – Supportare il/i caregiver – Bibliografia
ASPETTI METODOLOGICI e DEFINIZIONE DEL PROBLEMA
Obiettivi
Gli obiettivi della Conferenza di Consenso promossa da APRIRE network sono:
Definire i criteri prognostici di terminalità specifici per il grande anziano.
Identificare gli interventi palliativi appropriati per l’assistenza e la cura del grande anziano, a domicilio, nelle strutture residenziali e in hospice.
Identificare gli interventi per il supporto alla famiglia e ai caregiver formali e informali.
Individuare criteri e indicatori per la valutazione della qualità dell’assistenza e della cura nelle fasi terminali della vita del grande anziano.
Metodo
Il metodo scelto è quello della Conferenza di Consenso (Sistema Nazionale per le Linee Guida, 2013)[1] che risulta essere uno degli strumenti disponibili per raggiungere, attraverso un processo formale, un accordo tra diverse figure rispetto a questioni sanitarie particolarmente controverse e complesse, favorendo la scelta di orientamenti il più possibile uniformi nella pratica clinica nell’ottica di fornire ai pazienti la migliore qualità di cura in rapporto alle risorse disponibili.
Per ciascuno dei 12 quesiti formulati dal Comitato Tecnico Scientifico è stata condotta una revisione della letteratura primaria e secondaria su tre database (PubMed, Cochrane e Cinahl) considerando gli ultimi 10 anni (ultima consultazione 31 marzo 2018). Sono stati inclusi anche articoli di letteratura suggeriti dai database come rilevanti e articoli individuati nella bibliografia dei singoli articoli.
La scelta dei database è stata determinata dal fatto che il tema della conferenza è multidisciplinare.
[1] Sistema nazionale per le linee guida “Come organizzare una Conferenza di Consenso” – Data di pubblicazione: novembre 2009 – Data di aggiornamento: novembre 2013
Comitato Tecnico Scientifico
APRIRE Network ha individuato un gruppo di esperti appartenenti alle diverse discipline coinvolte che hanno costituito il Comitato Tecnico Scientifico che ha elaborato il presente documento.
Componenti il Comitato Tecnico Scientifico:
Ermellina Zanetti, Infermiera VicePresidente Associazione APRIRE Network, Coordinatore Comitato Tecnico Scientifico;
Daniele Bellandi, Medico geriatra Fondazione Istituto Ospedaliero di Sospiro Onlus, Sospiro (CR).
Cinzia Bertelli, Infermiera cure palliative ANT;
Corrado Carabellese, Medico geriatra Fondazione Casa di Dio Brescia, Associazione Geriatri Extraospedalieri;
Deborah Chiesa, Medico Specializzanda in Geriatria Università degli Studi di Brescia;
Simonetta Di Meo, Infermiera Dirigente Servizio Infermieristico Territoriale ASST Spedali Civili BS;
Gianbattista Guerrini, Medico geriatra Fondazione Brescia Solidale; Società Italiana di Gerontologia e Geriatria;
Pierangelo Lora Aprile, Medico di Medicina Generale ATS Brescia – Desenzano del Garda; Società Italiana di Medicina Generale e delle Cure Primarie;
Gian Franco Massarelli, rappresentante dei pazienti Associazione “Dall’altra parte: medici, infermieri, operatori e pazienti insieme”;
Federico Nicoli, Bioeticista Servizio di Etica Clinica presso Casa di Cura Domus Salutis Brescia -Fondazione Teresa Camplani; Centro di Ricerca in Etica Clinica Università degli Studi dell’Insubria, Varese;
Paola Ponton, Psicologa Azienda per l’Assistenza Sanitaria AAS N.3 Friuli;
Serena Sperotto, Infermiera Cure Domiciliari ASST Brescia;
Giovanni Zaninetta, Medico palliativista Unità Operativa di Cure palliative Casa di Cura Domus Salutis Brescia – Fondazione Teresa Camplani; Società Italiana Cure Palliative.
Panel Giuria
La Federazione Nazionale Ordini dei Medici Chirurghi e Odontoiatri, la Federazione Nazionale Ordini delle Professioni Infermieristiche, il Consiglio Nazionale dell’Ordine degli Psicologi, l’Istituto Superiore di Sanità, il Centro di Ricerca per l’Etica Clinica – Università dell’Insubria – Varese, le Società Scientifiche (Associazione Geriatri Extraospedalieri, Associazione Infermieri di Famiglia e Comunità, Associazione Italiana di Psicogeriatria, Società Italiana Cure Palliative, Società Italiana di Gerontologia e Geriatria, Società Italiana di Medicina Generale, Società Italiana di Geriatria Ospedale Territorio) su invito di APRIRE hanno costituito il Panel Giuria che ha valutato il documento preliminare, ha proposto correzioni e integrazioni e, in sede di Conferenza di Consenso celebrata a Roma il 24 ottobre 2018, ha approvato il presente Documento di Consenso.
Componenti il Panel Giuria:
Fulvio Borromei, Medico di Medicina Generale, Federazione Nazionale Ordini dei Medici Chirurghi e Odontoiatri;
Flavia Caretta, Medico Geriatra, Società Italiana di Gerontologia e Geriatria (SIGG);
Mariangela Cogoni, Infermiera, Federazione Nazionale Ordini Professioni Infermieristiche (FNOPI);
Renato Fanelli Medico di Medicina Generale, Società Italiana di Medicina Generale e delle cure primarie (SIMG);
Giuseppe Galetti, Medico geriatra, Società Italiana di Geriatria Ospedale Territorio (SIGOT);
David Lazzari, Psicologo, Consiglio Nazionale Ordine degli Psicologi (CNOP);
Italo Penco, Presiente Società Italiana Cure Palliative (SICP);
Mario Picozzi, Direttore Centro di Ricerca in Etica Clinica Università dell’Insubria Varese;
Stefano Pieretti, Primo Ricercatore presso Istituto Superiore di Sanità (ISS);
Salvatore Putignano, Medico Geriatra, Associazione Geriatri Extraospedalieri (AGE);
Consuelo Rota, Infermiera, Federazione Nazionale Ordini Professioni Infermieristiche (FNOPI);
Flaminia Rozzi, Infermiera, Associazione Infermieri di Famiglia e Comunità (AIFeC);
Marco Trabucchi, Presidente Associazione Italiana di Psicogeriatria (AIP).
Presidenti della Conferenza di Consenso
Fulvio Lonati, Presidente APRIRE Network
Gianlorenzo Scaccabarozzi, Presidente Comitato Scientifico Fondazione Floriani
Moderatori della Conferenza di Consenso
Matteo Crippa, Fondazione Floriani
Giacomo Pellegrini, Fondazione Floriani
Dichiarazione conflitto di interesse
Come è noto, la conferenza di consenso è una modalità di risposta a quesiti relativi all’efficacia e ai rischi di applicazioni cliniche e interventi biomedici o di sanità pubblica oggetto di specifiche controversie, con l’obiettivo di ridurre la variabilità dei comportamenti e/o orientare la ricerca futura verso quelle aree poco esplorate ma ritenute significative da tutti i soggetti interessati. Nello sviluppo dei documenti per la pratica clinica, è necessario assicurare che le valutazioni siano affidate ad esperti dotati delle migliori competenze tecnico-scientifiche, i quali potrebbero avere degli interessi legati alla loro stessa expertise.
Per garantire l’integrità del giudizio professionale e preservare la fiducia dei cittadini, tutti i soggetti coinvolti nella redazione, valutazione e approvazione del Documento di Consenso “Cure palliative nel grande anziano a domicilio, nelle residenze e in hospice” hanno dichiarato, su apposito modulo predisposto dal Centro di Eccellenza Clinica, la Qualità e la Sicuezza delle Cure dell’Istituto Superiore di Sanità (CNEC, 2018), la loro situazione relativa a ad ogni interesse finanziario, professionale o di altro tipo rilevante per l’argomento in esame che potrebbero indebitamente influenzare l’imparzialità del giudizio. I componenti del Comitato Tecnico Scientifico, del Panel Giuria, i Presidenti e i Moderatori della Conferenza di Consenso hanno dichiarato l’assenza di interessi finanziari, professionali o di altro tipo rilevanti per il tema della Conferenza di Consenso.
Supporto incondizionato
Hanno contribuito alla realizzazione della Conferenza di Consenso:
Ente Nazionale di Previdenza ed Assistenza Medici (E.N.P.A.M.) che ha messo a disposizione la propria sede per la celebrazione della Conferenza di Consenso.
Fondazione Guido Berlucchi che ha contribuito alle spese per la realizzazione della Conferenza di Consenso con una donazione liberale all’Associazione APRIRE-onlus di Euro 8.000,00. Tutte le spese sostenute (viaggi e ospitalità Comitato Tecnico Scientifico, Panel Giuria, Presidenti e Moderatori della Conferenza; stampa dei programmi e del materiale per la Conferenza; coffee breack e lunch) sono rendicontate e pubblicate sul sito Aprire Network alla pagina: https://www.aprirenetwork.it/assemblea/
Fondazione Floriani che ha supportato la redazione del Documento e la Celebrazione della Conferenza attraverso la Consulenza, la Presidenza e la Moderazione degli esperti: Dr. Lorenzo Scaccabarozzi, Dr. Matteo Crippa e Dr. Giacomo Pellegrini.
ASPETTI INTRODUTTIVI
A cura del comitato tecnico scientifico
Dal loro esordio negli anni sessanta nel Regno Unito, le cure palliative si sono estese in tutto il mondo occidentale, acquistando le caratteristiche di una vera e propria disciplina specialistica (Hillier 1988). Sviluppatesi nel contesto assistenziale della malattia oncologica avanzata, le cure palliative sono state in seguito estese all’AIDS o ad altre malattie croniche come lo scompenso cardiaco, l’insufficienza renale, l’insufficienza epatica, le broncopneumopatie croniche ostruttive e le sindromi neurologiche degenerative. Terminale viene inteso comunemente il paziente con aspettativa di vita non superiore a sei mesi, ma l’identificazione in termini così rigidi si è dimostrata difficile da attuare, in particolare nel caso di diagnosi non correlate al cancro (Venturiero et al. 2000; Christakis and Lamont 2000). Per ovviare a questa grave limitazione, il National Hospice Organization (Stuart, 1996) negli Stati Uniti, ha proposto dei criteri di eleggibilità per il ricovero in hospice, basati su dati anamnestici, clinici e laboratoristici che sono stati successivamente utilizzati per l’identificazione dei pazienti terminali. Tuttavia, il tentativo di validazione clinica di tali criteri in pazienti con malattie croniche avanzate non neoplastiche, ha dimostrato la loro inattendibilità predittiva (Fox et al. 1999). L’accuratezza predittiva di terminalità, utilizzando criteri rigidi, risulta ancor più difficile nei pazienti anziani e molto anziani, caratterizzati da polipatologia, politerapia e dalla presenza di disabilità funzionale e cognitiva, per lo più con le caratteristiche della disabilità progressiva.
L’Organizzazione Mondiale della Sanità afferma da tempo che i principi delle cure palliative dovrebbero essere applicati il più precocemente possibile nel corso di una malattia cronica (Sepúlveda et al. 2002)anche in considerazione del fatto che nei paesi ad alto reddito, il 75% delle morti è causato da condizioni croniche progressive avanzate.
Il progressivo e rapido invecchiamento generale della popolazione e il costante incremento dell’incidenza e prevalenza di condizioni di cronicità complesse comportano condizioni cliniche di estrema fragilità e di grave sofferenza. Si stima che per l’1,5% della popolazione l’accesso alle Cure Palliative (CP) sia appropriato e necessario (Scaccabarozzi et al.2015).
L’approccio moderno al fine vita si divide in due momenti: il primo, spesso mesi o anni prima della morte, può costituire l’inizio del processo di identificazione dei pazienti con necessità di cure palliative attraverso il riconoscimento di alcuni indicatori o variabili che facilitano l’identificazione precoce; il secondo riguarda gli ultimi giorni o settimane di vita e corrisponde al paradigma fuori moda della fornitura di cure palliative molto tardiva (Boyd and Murray 2010).
Tuttavia si osserva in tutti i setting di cura e assistenza (ospedale, strutture socio sanitarie, cure intermedie e assistenza domiciliare) la difficoltà a riconoscere il bisogno di cure palliative nel grande anziano, ovvero quando la cura e l’assistenza, da preventiva, curativa, riabilitativa debba esclusivamente assicurare interventi che massimizzino il comfort, il controllo dei sintomi disturbanti con l’obiettivo di garantire la qualità della vita.
Dati di letteratura documentano che nelle strutture residenziali per anziani dinanzi ad un progressivo peggioramento del quadro clinico e funzionale, anche in un soggetto molto fragile, vi è difficoltà e incertezza ad individuare l’avvicinarsi del fine della vita: il 30% degli anziani inviati in ospedale per accertamenti e trattamenti, muore in ospedale (Barclay et al. 2014).
Ahearn ha analizzato tutte le ammissioni in un periodo di 94 giorni presso un’unità di medicina per acuti di un ospedale inglese, confrontando coloro che provenivano da strutture residenziali con gli ultra settantenni provenienti dal domicilio. I residenti avevano significativamente meno probabilità di sopravvivere al ricovero delle persone anziane che vivevano a domicilio: 33,9% dei residenti è deceduto in ospedale rispetto al 15,7% coloro che provenivano dal domicilio (OR 2,76 CI 1,6-4,7 p=0.0002). Dopo 6 settimane dall’ammissione in ospedale, tra coloro che sono stati dimessi presso la stessa struttura residenziale da cui provenivano prima del ricovero, il 14,6% ha avuto un re-ricovero e il 26,8% è deceduto. Gli anziani con un livello più elevato di comorbilità avevano meno probabilità di sopravvivere al ricovero e maggior rischio di morte a 6 settimane dal ricovero (Ahearn et al. 2010).
La precoce identificazione dei grandi anziani che potrebbero beneficiare di interventi palliativi si è dimostrata efficace sia per quanto riguarda il miglioramento della qualità di vita degli anziani e dei loro famigliari, sia per una riduzione dei costi a fronte di una migliore appropriatezza degli interventi (Temel et al. 2010; Greer et al. 2012; McNamara et al. 2013).
Una revisione della letteratura (Cimino and McPherson 2014) ha evidenziato che l’approccio palliativo ad anziani ospiti di strutture residenziali migliora gli esiti clinici, i processi di assistenza e la percezione della qualità delle cure da parte dei familiari. In particolare migliora la gestione del dolore e degli altri sintomi disturbanti (dispnea, affaticamento) e l’appropriatezza delle terapie farmacologiche.
Grande anziano: definizione
Gianbattista Guerrini, Deborah Chiesa, Corrado Carabellese, Daniele Bellandi
La percentuale di persone anziane nella popolazione è in aumento in quasi tutti i paesi. Entro il 2050, circa 2 miliardi di persone nel mondo avranno un’età di 60 anni o più, con 400 milioni di persone di età superiore agli 80 anni.
L’aumento progressivo dell’aspettativa di vita ed il miglioramento delle condizioni cliniche e funzionali che, secondo gli studi di coorte, ha accompagnato tale fenomeno ha da tempo indotto a distinguere una “terza età” definita prevalentemente su base cronologica (l’aver compiuto e superato i 65 anni) da una “quarta età” (il cui limite cronologico si è andato spostando negli ultimi decenni dai 75 agli 80 agli 85 anni) caratterizzata, “pur nell’estrema variabilità delle espressioni fenotipiche” da “maggiore e più intenso declino biologico e funzionale, con elevata morbosità e fragilità” (Senin et al. 2013) e da un crescente rischio di ospedalizzazione, di istituzionalizzazione e di morte.
Con il termine “grande vecchio” (oldest old) si vuole far riferimento alla persona che ha intrapreso l’ultimo tragitto del suo percorso di invecchiamento connotato:
da un’età molto avanzata (>85);
dalla progressiva difficoltà a ricostruire nuovi equilibri clinico-funzionali in risposta alle modificazioni indotte dal processo di invecchiamento, dall’accumularsi negli anni delle conseguenze della (poli)patologia cronica e dal rapporto della persona con il contesto di vita;
da una condizione di crescente “fragilità” intesa, al di là del suo fenotipo somatico e cognitivo, come uno stato di maggiore vulnerabilità agli stress che comporta un aumentato rischio di disabilità, declino funzionale, ospedalizzazione e mortalità (Fried et al. 2001). Con riferimento alla popolazione generale studi in tutto il mondo riportano che la prevalenza della fragilità varia dal 4,9% al 27,3% (Choi, Ahn, and Kim 2015);
dalla coesistenza di multiple malattie croniche (e, di conseguenza, di sintomi e politerapia cronici) tra di loro interagenti (Kane 2002);
dall’alto rischio o dalla presenza di “disabilità” funzionale, per lo più con le caratteristiche della disabilità progressiva (Ferrucci et al. 1996);
dall’elevata prevalenza di compromissione cognitiva;
dalla necessità di supporto sociosanitario e, non raramente, dalla debolezza della rete di supporto familiare e di prossimità.
In questa prospettiva la cura del grande vecchio pone la medicina di fronte a due sfide:
da una parte la necessità di affrontare la complessità e l’instabilità tipiche della condizione clinica ed esistenziale di questi pazienti, mantenendo l’equilibrio tra accanimento terapeutico ed abbandono (ageism) integrando la medicina dell’evidenza con la presa in carico multidimensionale, l’approccio funzionale e la valorizzazione dei nuovi equilibri clinico-funzionali;
dall’altra la difficoltà di individuare, nel continuum che spesso caratterizza la traiettoria verso la disabilità, il punto in cui viene superata la soglia dell’irreversibilità della condizione clinica e diventa indispensabile l’approccio sintomatico e palliativo.
Il vissuto odierno del morire
Federico Nicoli, Paola Ponton
Nelle strutture sanitarie e assistenziali si presentano quotidianamente molteplici situazioni in cui si pongono questioni rilevanti riguardo all’approccio terapeutico al grande anziano portatore di comorbilità e affetto da una malattia inguaribile che si sta avvicinando alla fine della vita. Tale condizione apre, per l’équipe sanitaria, scenari terapeutici di non facile soluzione. Al contempo, nella società occidentale contemporanea, sovente i temi del fine vita e della morte sono celati da un velo che rende ostica anche una semplice comprensione delle difficoltà riscontrate nelle strutture sanitarie e assistenziali. Vivere più a lungo, raggiungere età molto elevate, prolungare la vita, ma non necessariamente la qualità della stessa, sono temi che animano un dibattito culturale presente sia nella letteratura scientifica sia nei mass media. Il dibattito si articola tra questioni antropologiche, sociologiche, giuridiche, etiche, psicologiche e sanitario-assistenziali all’interno di un tempo qualificato come “il tempo delle scelte” (Black and Csikai, 2015).
Pensare alla morte, dare un senso alla morte, affrontare la morte, definire la morte sono questioni che hanno permeato il pensiero dell’umanità, epoca dopo epoca, in un continuum tra evitamento e fronteggiamento. Nel secolo scorso Aries e Gorer hanno sostenuto che la civiltà occidentale avesse sostituito il tabù del sesso con quello della morte attuando una rimozione della stessa e da allora diversi studi hanno evidenziato come reazioni di rimozione, di negazione, di evitamento, di fuga o di nascondimento caratterizzano la nostra società (Ross, 1976), che pur talvolta la edulcora (la cosiddetta “morte amica”) o la esibisce tra mistificazioni o spettacolarizzazioni. Negli ultimi due decenni tuttavia è in atto un importante processo di trasformazione culturale, di cambiamento di prospettive non sempre di facile interpretazione, sia per gli aspetti evolutivi che per la mancanza di studi estesi (Mola and Crisci 2001)o dedicati a specifiche coorti di popolazione come i grandi anziani. Sicuramente il movimento per le cure palliative ha attivato nuove sensibilità nel mondo sanitario e nella popolazione con un approccio più pragmatico e concreto al morire e all’ultimo tempo della vita, percepiti come spazio e tempo per azioni, scelte, espressioni di volontà soggettive, quasi a riappropriarsi di questo tempo della propria vita, anziché restare annichiliti dall’angoscia della morte.
La possibilità di intervenire su una persona molto anziana alla fine della vita, apre questioni che riguardano non solamente la giurisprudenza – cosa sia lecito fare o non fare – ma anche aspetti culturali, etici e psicologici. Questi aspetti toccano il morente e tutti coloro che sono coinvolti nella situazione: operatori e familiari innanzitutto.
Il tema della morte mette in gioco fattori diversi che rendono difficile l’identificazione di certezze univoche e condivise. Ciò dipende dal fatto che la mappa dei valori morali del mondo contemporaneo nella relazione medico-paziente è supportata sia da diversi principi – autonomia, beneficenza, non maleficenza, giustizia – (Beauchamp and Childress, 2009) sia da riferimenti culturali e religiosi eterogenei e da una certa difficoltà ad affrontare il tema della fine della vita, qualora non si sia direttamente chiamati in causa. Complessità e ambivalenza connotano ogni analisi sul tema: la ricerca clinica e il progresso tecnologico sembrano sostenere la possibilità di affrontare in modo approfondito e condiviso questo tema, ma al contempo il crescente potere della tecnica e delle biotecnologie offre potenti antidoti alla morte, come se questa potesse essere allontanata per un tempo illimitato. Analogamente studi e progetti affrontano in modo pragmatico il tempo della fine della vita (SIAARTI, 2018; SICP-SIN, 2018), ed altri introducono dimensioni spirituali e valutazioni che oltrepassano gli aspetti scientifici tradizionali (Testoni, 2014; Arnold and Lloyd 2014)chiedendo nuove sensibilità anche al mondo sanitario-assistenziale. Sul piano etico infine, la soggettività si può declinare nell’assoluta difesa del principio di autonomia che tuttavia cela spesso un vissuto di solitudine della persona, dei famigliari e degli operatori sanitari, che sono chiamati quotidianamente a rispondere anche con atti clinici. Si viene così a definire una sorta di zona grigia in cui il criterio della proporzionalità dei trattamenti non risulta essere ben definito e ben comprensibile agli attori impegnati nella gestione di un caso clinico.
Non è facile comprendere e condividere i momenti di sofferenza della persona per coloro che se ne prendono cura: la complessità nel bilanciare valori e opzioni terapeutiche differenti richiede di imprimere un significato che la rappresenti ai gesti e alle scelte dei vari protagonisti.
Anche in questo caso, infatti, alcune ricerche evidenziano una forte spinta verso processi di partecipazione nella costruzione delle preferenze riguardo il fine vita (Lloyd-Williams et al. 2007; Steinhauser et al. 2001; Borreani et al. 2008;Kelly 2006) orientate ad evitare posizioni estreme, soprattutto di tipo eutanasico.
La difficoltà nel gestire la sofferenza, dovuta dalla contraddizione tra la richiesta di perfezione, di benessere, di felicità, di amore e la privazione di tutto ciò, determinata dalla malattia terminale, apre questioni che il diritto e la bioetica sono chiamati ad affrontare.
La legge N° 38 del 2010 sulla terapia del dolore e le cure palliative, la recente legge sul fine vita (Legge 22 dicembre 2017- n. 219)e, prima ancora, la Costituzione Italiana affermano in modo inequivocabile tre importanti principi: l’inviolabilità della libertà, l’autonomia e la solidarietà sociale. Lo Stato tutela e difende la libertà, la vita e la salute dei singoli cittadini lungo tutto l’arco della loro vita anche se tali diritti talvolta possono tra loro opporsi.
Anche in ambito bioetico si riscontra un’importante riflessione in merito alla fine della vita considerando differenti principi e modelli, i quali, se presi singolarmente, non riescono a offrire una soluzione univoca ai quesiti presenti nella quotidiana pratica clinica. Scegliere come sia più corretto procedere, considerando le preferenze della persona e dei famigliari e le possibilità che l’arte medica permette, può essere una delle grandi sfide del prossimi anni.
Nella pratica clinica è possibile cercare soluzioni alla complessità e al conflitto, adoperandosi per un lavoro centrato sulla persona, la sua storia, la sua identità, i suoi bisogni, valori, desideri e legami, affinché la sua dignità possa essere rispettata. Un obiettivo della pratica clinica nello scenario della fine della vita è il sostegno alle persone nella ricerca della consapevolezza della propria finitudine, dei propri desideri, ma anche delle paure e delle resistenze e delle fragilità incombenti.
Una sfida a cui la medicina contemporanea “costringe” inevitabilmente, per la necessità di valutare tra le diverse possibili alternative di cura e di assistenza: ciascuno è pertanto chiamato a ricercare la propria “misura”, e ad offrire il proprio giudizio di proporzionalità, insieme ai curanti, affinché all’insistenza terapeutica si sostituisca l’accompagnamento invece che il temuto abbandono.
Accompagnamento e condivisione che non sono solo il risultato di un’argomentazione astratta, ma, anzitutto, il frutto di un investimento emotivo-affettivo (e relazionale) a servizio della persona.
Desideri e preferenze nel grande anziano con limitata attesa di vita: comunicazione della prognosi e pianificazione delle cure
Pierangelo Lora Aprile, Federico Nicoli
“Nothing about me without me” (Gerteis, 1993) è lo slogan emblema di un modello di cura centrato sulla persona e fondato sulla relazione tra chi riceve le cure e chi le offre.
C’è chi afferma che l’evoluzione della qualità delle cure in sanità è rappresentata dal passaggio dall’appropriatezza al valore (Ricciardi, 2008), inteso come “un qualcosa che in quanto prodotto o servizio valga per qualcuno, in relazione ad altre cose (spesso misurato in danaro)”.Il concetto di “valore” è strettamente collegato con quello di “patient-centredness” che nel corso delle ultime decadi è divenuta una dimensione, riconosciuta a livello internazionale, del più ampio concetto di qualità dell’assistenza sanitaria (Australian Commission on Safety and Quality in Health Care 2010).
Una delle otto dimensioni dei modelli di cura centrati sulla persona, definiti da un gruppo di lavoro della Harvard Medical School (http://pickerinstitute.org/about/picker-principles) è il rispetto dei valori, delle preferenze e dei bisogni espressi e riguarda la condivisione delle responsabilità delle decisioni tra chi assiste e chi è assistito, compresi amici e familiari: si tratta di focalizzare l’attenzione su una dimensione che riguarda il livello micro dell’assistenza sanitaria, ovvero la cura del singolo individuo ed è chiaro che a questo livello i pazienti possono offrire informazioni e approfondimenti sul significato di dignità, rispetto, privacy, bisogno di informazioni e conoscenza (N. Black and Jenkinson 2009).
“There Are Things I Can’t Do Anymore That I Wish I Could…” (Boockvar, Meier, and Story 2006): l’articolo introduce un rilevante aspetto delle cure palliative ai “grandi anziani” fragili. La storia di Mrs. K (89 anni) e del suo curante, Dr. T è un pretesto per affontare le modalità comunicative tra curante e curato nell’ottica di valutare i desideri e le preferenze, non tralasciando l’aspetto più rilevante che è quello di affrontare il problema della prognosi.
Il dialogo inizia con Mrs. K che fa una considerazione di frequente riscontro negli anziani: “Penso che sono andata molto avanti e che non posso durare ancora a lungo…”. E’ qui che si aggancia il Dr. T, che lungi dal banalizzare, minimizzare o sviare il discorso, raccoglie la provocazione e inizia una franca comunicazione sullo stato di salute di Mrs. K: l’insufficienza cardiaca che è progredita, la difficoltà di respiro e, rifacendosi a precedenti discussioni, le chiede se ritiene ancora valido l’accordo di qualche mese prima sulla rinuncia alle procedure DNR-DNI (Do Not Resuscitation–Do Not Intubate).
Il Progetto Arianna, uno studio osservazionale multicentrico, della durata complessiva di 18 mesi, promosso da Fondazione G. Berlucchi e Agenas, ha arruolato e monitorato pazienti con un aspettativa di vita inferiore ai 12 mesi. Lo studio ha avuto inizio il 1 marzo 2014 ed è terminato il 31 agosto 2015 e prevedeva che i Medici di Medicina Generale, dopo aver identificato con il Gold Standards Framework (GSF) (Thomas, 2011) i malati cronici in fase avanzata e con limitata aspettativa di vita, programmassero un colloquio strutturato finalizzato a discutere della prognosi. I risultati hanno rilevato che solo il 6% degli assistiti ha avuto un colloquio con il proprio medico durante il quale è stato affrontato il problema prognostico e, di questi, solo il 22% aveva accanto un famigliare (Scaccabarozzi, 2016).
La relazione tra tutti i protagonisti coinvolti in uno specifico caso clinico può essere riconosciuta come “luogo”ideale nel quale le competenze delle diverse figure sanitarie e la storia, non solo clinica, della persona e dei famigliari possano trovare una giusta sintesi per la condivisione di specifiche scelte. I diversi soggetti coinvolti possono avere differenti punti di vista: affrontarli sembra essere l’unica modalità per dar forma a quell’alleanza terapeutica che di per sè si struttura mettendo in relazione soggetti con competenze differenti. Tale alleanza ha un duplice obiettivo, da una parte evitare incomprensioni e silenzi comunicativi tra équipe, paziente e famigliari e dall’altra far interagire diversi soggetti con conoscenze e competenze differenti. Per l’équipe sanitaria, l’alleanza terapeutica comporta la piena comprensione dell’importanza del criterio della proporzionalità dei trattamenti – ove si incontrano la situazione clinica (considerando anche le chances di successo e la speranza di vita) e le preferenze della persona (tenendo conto anche degli oneri psicofisici per la persone e la sua famiglia). Per la persona e i suoi famigliari, l’alleanza terapeutica porta a riconoscere la validità di quel rapporto di fiducia nel quale, data un’incertezza prognostica, si è in grado di procedere con gradualità sentendosi pienamente compresi.
Cambio di paradigma: gestione dei sintomi e qualità della vita
Federico Nicoli, Giovanni Zaninetta
Negli ultimi tempi della vita deve prevalere l’attenzione alla condizione esistenziale piuttosto che alla condizione clinica della persona (Drane JF, 2010). Ciò può essere valorizzato da una grande attenzione alla dimensione soggettiva la quale richiama ad una priorità, quella di consentire alla persona, per quanto possibile, di concludere la vita secondo le proprie preferenze piuttosto che porre attenzione ed energie nella vana speranza di poter guarire da malattie che ormai non rispondono più ai trattamenti (Wilkie and Ezenwa 2013).
L’analisi in merito alla qualità della vita, irrimediabilmente segnata dall’evolversi di una patologia cronica evolutiva, si basa sul criterio della proporzionalità dei trattamenti (Lynn et al. 2002) che sposta l’attenzione, in questi momenti della vita, dal tentativo di fermare o rallentare stricto sensu l’evoluzione della patologia alla cura della persona e dei suoi sintomi. A questo punto della progressione della malattia i trattamenti si delineano come proporzionati se orientati ad offrire alla persona la possibilità di vivere una vita buona per ciò che ne resta.
Superando la frammentazione dell’approccio clinico finalizzato ad un futile controllo di una o più malattie non più controllabili, ci si deve orientare al gestire al meglio i sintomi disturbanti che le patologie recano con sè.
Il rapporto tra criteri clinici e preferenze della persona si delinea nella nozione di “qualità di vita” la cui interpretazione in relazione alla cura della malattia, apre a quella tipologia di trattamenti palliativi orientati da una parte al controllo dei sintomi e dall’altra ad offrire, per quanto possibile, la più alta qualità di vita alla persona malata.
In particolare, la necessità di personalizzare l’approccio diagnostico-terapeutico si manifesta nello stabilire all’interno delle terapie prescritte per le varie patologie una priorità che tenga conto del possibile trattamento causale dei sintomi e della scarsa invasività delle terapie stesse. Una riflessione ulteriore è riferita al setting clinico in cui la persona è assistita, individuando nei casi specifici l’opportunità di evitare trasferimenti inappropriati in ospedali per acuti se non indirizzati al controllo, non altrimenti realizzabile, di sintomi disturbanti.
Rimodulare gli interventi in relazione a prospettive realistiche significa non attuare acriticamente tutti i provvedimenti diagnostico-terapeutici che sarebbero in teoria disponibili.ma esercitare un attivo discernimento sulle priorità e sulla loro proporzionalità,grazie alla relazione tra persona, medico e familiari, nella quale alla persona spetta, ove possibile, la decisione finale.
Perdere di vista la qualità della vita di una persona che si sta avvicinando alla morte significa non riconoscere, anche in questo frangente, la presenza piena, anche solo nell’accompagnamento, di un atto medico-assistenziale necessario.
Bibliografia
Ahearn, D. J., Jackson, T. B., McIlmoyle, J., & Weatherburn, A. J. (2010). Improving end of life care for nursing home residents: an analysis of hospital mortality and readmission rates. Postgraduate Medical Journal, 86(1013), 131–135.
Arnold, B. L., & Lloyd, L. S. (2014). Harnessing Complex Emergent Metaphors for Effective Communication in Palliative Care: A Multimodal Perceptual Analysis of Hospice Patients’ Reports of Transcendence Experiences. American Journal of Hospice and Palliative Medicine, 31(3), 292–299.
Australian Commission on Safety and Quality in Health Care. (2010). Patient – Centred Care: Improving Quality and safety by focusing care on Patients and Consumer (Discussion Paper).
Barclay, S., Froggatt, K., Crang, C., Mathie, E., Handley, M., Iliffe, S., … Goodman, C. (2014). Living in uncertain times: Trajectories to death in residential care homes. British Journal of General Practice,64(626), e576–e583.
Beauchamp TL, Childress JF, Principles of Biomedical Ethics, New York, Oxford University Press, 2009
Bertolissi, S., Miccinesi, G., & Giusti, F. (2012). Come si muore in Italia Storia e risultati dello studio Senti-MELC. Rivista Della Società Italiana Di Medicina Generale, 2, 17–34.
Black, K., & Csikai, E. L. (2015). Dying in the Age of Choice. Journal of Social Work in End-of-Life and Palliative Care, 11(1), 27–49.
Black, N., & Jenkinson, C. (2009). How can patients’ views of their care enhance quality improvement? British Medical Journal,339(jul02_1), b2495.
Boockvar, K. S., Meier, D. E., & Story, T. H. E. P. S. (2006). Palliative Care for Frail Older Adults “ There Are Things I Can ’ t Do Anymore That I Wish I Could . . . ” JAMA : The Journal of the American Medical Association, 296(18), 2245–2254.
Borreani, C., Brunelli, C., Miccinesi, G., Morino, P., Piazza, M., Piva, L., & Tamburini, M. (2008). Eliciting Individual Preferences About Death: Development of the End-of-Life Preferences Interview. Journal of Pain and Symptom Management, 36(4), 335–350.
Boyd, K., & Murray, S. A. (2010). Recognising and managing key transitions in end of life care. BMJ (Online), 341:c4863.
Choi, J., Ahn, A., & Kim, S. (2015). Global Prevalence of Physical Frailty by Fried’s Criteria in Community-Dwelling Elderly With National Population-Based Surveys. Journal of the American Medical Directors Association, 16(7), 548–550.
Christakis, N. A., & Lamont, E. B. (2000). Extent and determinants of error in doctors’ prognoses in terminally ill patients: prospective cohort study. BMJ: British Medical Journal, 320(7233), 469–473.
Cimino, N. M., & McPherson, M. L. (2014). Evaluating the Impact of Palliative or Hospice Care Provided in Nursing Homes. Journal of Gerontological Nursing, 40(10), 10–14.
CNEC Centro Nazionale per l’Eccellenza Clinica, la Qualità e la Sicurezza delle Cure Manuale metodologico per la produzione di linee guida di pratica clinica v. 1.2 luglio 2018https://snlg.iss.it/wp-content/uploads/2018/10/MM_v1.2_lug-2018.pdf
Ferrucci, L., Guralnik, J. M., Simonsick, E., Salive, M. E., Corti, C., & Langlois, J. (1996). Progressive versus catastrophic disability: a longitudinal view of the disablement process. The Journals of Gerontology. Series A, Biological Sciences and Medical Sciences, 51(3), M123–M130
Fox, E., Landrum-McNiff, K., Zhong, Z., Dawson, N. V., Wu, A. W., & Lynn, J. (1999). Evaluation of prognostic criteria for determining hospice eligibility in patients with advanced lung, heart, or liver disease. JAMA : The Journal of the American Medical Association, 282(17), 1638–45.
Fried, L., Tangen, C. M., Walston, J., Newman, A. B., Hirsch, C., Gottdiener, J., … McBurnie, M. A. (2001). Frailty in Older Adults: Evidence for a Phenotype. Journal of Gerontology: Medical Sciences, 56A(3), M146–M156.
G.U. n. 12 del 16-1-2018. (2018). LEGGE 22 dicembre 2017- n. 219 Norme in materia di consenso informato e di disposizioni anticipate di trattamento.
Gerteis M, Edgman-Levitan S, Daley J, Delbanco TL. (eds). Through the Patient’s Eyes. San Francisco, Jossey-Bass, 1993
Greer, J. A., Pirl, W. F., Jackson, V. A., Muzikansky, A., Lennes, I. T., Heist, R. S., … Temel, J. S. (2012). Effect of early palliative care on chemotherapy use and end-of-life care in patients with metastatic non-small-cell lung cancer. Journal of Clinical Oncology, 30(4), 394–400.
Hillier, R. (1988). Palliative medicine. British Medical Journal, 297(October), 874.
http://progettodemetra.it/index.php/it/arianna-interrai-conference-2016/file
Kane, R. L. (2002). The future history of geriatrics: geriatrics at the crossroads. The Journals of Gerontology. Series A, Biological Sciences and Medical Sciences, 57(12), M803-5.
Kelly DF, Medical care at the End of Life. A Catholic Perspective, Washington D.C., Georgetown University Press, 2006.
Lloyd-Williams, M., Kennedy, V., Sixsmith, A., & Sixsmith, J. (2007). The End of Life: A Qualitative Study of the Perceptions of People Over the Age of 80 on Issues Surrounding Death and Dying. Journal of Pain and Symptom Management, 34(1), 60–66.
Lynn L.A., Sulmasy D.P. (2002) Proportionality, terminal suffering and the restorative goals of medicine. Theoretical Medicine 23(4-5):321-37.
McNamara, B. A., Rosenwax, L. K., Murray, K., & Currow, D. C. (2013). Early Admission to Community-Based Palliative Care Reduces Use of Emergency Departments in the Ninety Days before Death. Journal of Palliative Medicine, 16(7), 774–779.
Mola, G. D., & Crisci, M. (2001). Attitude towards death and dying in a representative sample of the Italian population. Palliative Medicine, 15(1), 372–8.
Pivodic, L., Pardon, K., Van Den Block, L., Van Casteren, V., Miccinesi, G., Donker, G. A., … Deliens, L. (2013). Palliative care service use in four European countries: A cross-national retrospective study via representative networks of general practitioners. PLoS ONE, 8(12).
Ricciardi W., Gray S.M. Per una sanità di valore. Come garantire servizi sanitari ottimali in un’epoca di risorse scarse. Iniziative Sanitarie. Roma, 2008
Ross EK, La morte e il morire, Cittadella 1976
Scaccabarozzi GL. World Inter-Rai Conference- Toronto, 2016.
Scaccabarozzi, G., Amodio, E., Azzetta, F., Canzani, F., Civillini, P., Limonta, F., Lombardi, F., Lora Aprile, P., Lovaglio, P., Manfredini, L., Peruselli, C., Piva, L., Valenti, D., Ventriglia, G., Colombo, E., Crippa, M., Pellegrini, G. Percorso integrato per la presa in carico della persona in condizioni di cronicità complesse e avanzate con bisogni di cure palliative.Un modello di clinical governance per lo sviluppo delle Reti Locali di Cure Palliative. DOCUMENTO di CONSENSO 2015 https://progettodemetra.it/index.php/it/documento-di-consenso-percorso-integrato-2015/file
Senin U, Bartorelli L, Salvioli G (Eds) (2013). I grandi vecchi: curare ancora. Carocci Faber, Roma
Sepúlveda, C., Marlin, A., Yoshida, T., & Ullrich, A. (2002). Palliative care: The world health organization’s global perspective. Journal of Pain and Symptom Management, 24(2), 91–96.
SIAARTI -Società Italiana di Anestesia Analgesia Rianimazione e Terapia Intensiva- Le cure di fine vita e l’anestesista rianimatore: raccomandazioni SIAARTI per l’approccio alla persona morente UPDATE 2018 http://www.siaarti.it/Ricerca/documento-siaarti-fine-vita.aspx
SICP- SIN (Società Italiana Cure Palliative e Società Italiana Neurologia ) Le cure palliative nel malato neurologico Documento intersocietario SICP-SIN 10 luglio 2018
Steinhauser, K., Christakis, N., Clipp, E., McNeilly, Ma., Grambow, S., Parker, J., & Tulsky, J. (2001). Preparing for the End of Life: Preferences of patients, families, and other care providers. Journal of Pain and Symptom Management, 22(3), 727–737.
Stuart B, Alexander C, Arenella C, et al. Medical guidelines for determining prognosis in selected non cancer diseases. 2nd ed. Arlington, Va. National Hospice Organization, 1996.
Temel, J. S., Greer, J. a, Muzikansky, A., Gallagher, E. R., Admane, S., Jackson, V. a, … Lynch, T. J. (2010). Early palliative care for patients with metastatic non-small-cell lung cancer. New Engl J Med, 363(8), 733–42.
Thomas K. Prognostic Indicators Guidance (PIG). 4th ed. The Gold Standards Framework Centre in End of Life Care CIC, 2011.
Venturiero, V., Tarsitani, P., Liperoti, R., Ardito, F., Carbonin, P., Bernabei, R., & Gambassi, G. (2000). Cure palliative nel paziente anziano terminale. Giornale Di Gerontologia, 48(4), 222–246.
Wilkie, D. J., & Ezenwa, M. O. (2013). Pain and Symptom Management in Palliative Care and at End of Life. Nursing Outlook, 360(9346), 1640–1645.
IDENTIFICAZIONE DEL GRANDE ANZIANO
CHE NECESSITA DI CURE PALLIATIVE
Corrado Carabellese, Gianbattista Guerrini, Daniele Bellandi, Ermellina Zanetti
Razionale
La precoce identificazione dei grandi anziani che potrebbero beneficiare di interventi palliativi si è dimostrata efficace sia per quanto riguarda il miglioramento della qualità di vita degli anziani e dei loro famigliari, sia per una riduzione dei costi a fronte di una migliore appropriatezza degli interventi (Hall et al., 2008).
Una revisione della letteratura (Cimino & McPherson, 2014)ha evidenziato che l’approccio palliativo ad anziani ospiti di strutture residenziali migliora gli esiti clinici, i processi di assistenza e la percezione della qualità delle cure da parte dei familiari. In particolare migliora la gestione del dolore e degli altri sintomi disturbanti (dispnea, affaticamento) e l’appropriatezza delle terapie farmacologiche. E’ ridotto l’utilizzo di interventi invasivi come la contenzione fisica e la Gastrostomia Endoscopica Percutanea della quale, nel caso della demenza, non è stata dimostrata l’efficacia sulla sopravvivenza (Ticinesi et al., 2016).
Per migliorare l’identificazione delle persone con malattia cronica avanzata che necessitano di cure palliative la letteratura recente si è concentrata su due aspetti:
- l’identificazione precoce dell’esigenza di cure palliative;
- le 3 traiettorie di fine vita nelle malattie croniche: acuta, intermittente e graduale.
Nel 2003 Lunney descrive tre distinte traiettorie di declino funzionale nel fine vita, illustrando i pattern dinamici tipici di un gruppo di soggetti classificati secondo la loro principale malattia cronica. La prima traiettoria clinica, tipicamente associata al cancro, presenta una fase di declino stabile e/o lento, interrotto da un grave e veloce declino nelle ultime settimane. La seconda è caratterizzata da un graduale declino, con episodi acuti di solito correlati ai processi concomitanti, all’evoluzione della malattia e al recupero parziale: questa traiettoria corrisponde a soggetti con malattie d’organo avanzate quali scompenso di cuore, insufficienza respiratoria, insufficienza renale e insufficienza epatica. Infine, la terza traiettoria mostra un progressivo declino a ritmo lento, tipicamente correlato a demenza o fragilità (Lunney et al., 2003).
Murray ha evidenziato le implicazioni cliniche delle traiettorie di fine vita presentandole come un framework utile ai professionisti che affrontano l’incertezza associata ad una condizione cronica avanzata in grado di evitare una paralisi prognostica e una conseguente non appropriata pianificazione delle cure e dell’assistenza (Murray, 2005). E’ infatti noto che la definizione della prognosi comporterà sempre un certo grado di incertezza (Yourman et al, 2012), poiché i processi del fine vita sono multifattoriali e rigorosamente individuali allo stesso tempo e, anche se alcune variabili sono largamente correlate ad un aumentato rischio di mortalità, non esiste un indicatore prognostico unico che identifica tutti i pazienti che moriranno a 6, 12 o 24 mesi. L’approccio prognostico classico focalizzato sui criteri di severità della malattia cronica avanzata ha delle limitazioni: le variabili centrate sulla malattia, se utilizzate da sole, hanno infatti dimostrato una bassa capacità prognostica, in particolare per i pazienti geriatrici con condizioni croniche multiple. Rispetto alla gravità o severità della malattia altri fattori hanno dimostrato di essere indicatori di fine vita più affidabili: lo stato funzionale e cognitivo, gli indicatori nutrizionali, i problemi emotivi; le sindromi geriatriche quali il delirium, la disfagia, le ulcere da pressione e le ripetute cadute; sintomi quali dispnea e ansia; la vulnerabilità sociale e l’uso delle risorse (accessi in pronto soccorso, ricoveri ripetuti) (Amblàs-Novellas et al., 2015).
Nelle persone anziane l’individuazione di coloro che possono avvalersi delle cure palliative (che comprendono la gestione dei sintomi, il supporto psicosociale e la condivisione degli obiettivi delle cure e delle aspettative e delle volontà del paziente) è resa possibile dalla Valutazione Multidimensionale (VMD), in grado di coglierne tempestivamente il declino funzionale, cognitivo e nutrizionale. La VMD è un processo – solitamente interdisciplinare – volto a quantificare in una persona anziana capacità e problematiche di carattere medico, psico-sociale e funzionale, allo scopo di predisporre un programma globale di trattamento e controllo nel tempo.La VMD si è dimostrata lo strumento più efficace per individuare i bisogni e le potenzialità della persona anziana, per definire la prognosi a breve e lungo termine e per predisporre un piano di cura personalizzato. La VMD risulta particolarmente utile nel grande vecchio in ragione dell’aumento con l’età della multimorbilità, dell’instabilità clinico-funzionale, della fragilità e della disabilità (Ellis et al., 2017; Pilotto et al., 2017).
Nell’ambito delle cure continuative, sia nei servizi domiciliari sia nei presidi residenziali, l’approccio multidimensionale e multidisciplinare è in grado di migliorare la qualità della cura e di ridurre il ricorso all’ospedalizzazione, dimostrando la maggior efficacia nei soggetti anziani più complessi (Panza et al., 2017). In particolare la VMD consente di identificare i soggetti anziani in condizioni di pre-fragilità e di fragilità, attivando là dove possibile interventi multimodali finalizzati a correggere i determinanti modificabili della fragilità e a migliorare le capacità funzionali o integrando precocemente la cura del paziente con un approccio palliativo orientato a migliorare la gestione dei sintomi e a promuoverne la dignità ed il benessere (Cardona-Morrell et al., 2017).
Nel grande anziano con aspettativa di vita limitata, nel quale la qualità della vita rappresenta il principale obiettivo della cura, l’applicazione sistematica dell’approccio valutativo multidimensionale consente, inoltre, di individuare e gestire le condizioni che sulla qualità della vita esercitano un’influenza negativa (dalla multimorbilità alla polifarmacoterapia, dalla fragilità alle sindromi geriatriche) e la loro evoluzione nel tempo (Baronner & MacKenzie, 2017). In particolare appare importante l’individuazione dei determinanti somatici (astenia e debolezza muscolare, calo ponderale, malnutrizione calorico-proteica) della fragilità, il più forte predittore di mortalità negli anziani che vivono a domicilio (Clegg et al., 2013), nonchè della coesistenza tra fragilità e compromissione cognitiva, che indica che la fase terminale della vita è già iniziata (Kulmala et al., 2013). La VMD può infine prendere in carico i bisogni spirituali della persona anziana, riconoscere i bisogni psicologici e relazionali della persona e della sua famiglia (di riconciliazione, di perdono, di riconoscimento, di commiato) (Swagerty 2017) nonchè verificare consistenzae competenze della famiglia e promuovere l’intervento della rete formale dei servizi.
L’integrazione della valutazione multidimensionale con l’approccio palliativo è ritenuta particolarmente importante nella cura e nell’assistenza alle persone che affrontano le fasi terminali della propria vita (Baronner & MacKenzie, 2017; Swagerty, 2017).
Quesito 1: Quali indicatori identificano la prognosi e il bisogno di cure palliative nel grande anziano?
Recentemente Amblàs-Novellas (Amblàs-Novellas et al., 2016)ha esaminato il rapporto tra indicatori di fine vita utilizzati nei soggetti con condizioni croniche avanzate e le tre traiettorie di fine vita. Nelle persone con fragilità avanzata, indipendentemente dalla traiettoria di fine vita e dal setting(ospedale, cure intermedie, residenze, domicilio), i seguenti indicatori sono più discriminanti della severità della condizione clinica per identificare la prognosi e il bisogno di cure palliative:
- Indicatori funzionali: perdita (non iatrogena) negli ultimi 6 mesi di 2 o più ADL o valutazione clinica di declino funzionale non relativo a condizioni concomitanti.
- Indicatori nutrizionali: perdita, negli ultimi 6 mesi, di più del 10% del peso o valutazione clinica di declino nutrizionale non relativo a condizioni concomitanti.
- Indicatori emotivi: presenza di stress emotivo con sintomi psicologici non correlato a condizioni acute concomitanti.
- Sindromi geriatriche: eventi occorsi negli ultimi 6 mesi: non risoluzione di lesioni da pressione (stadi III-IV NPUAP[1]), infezioni ricorrenti (2 o più eventi), delirium, disfagia persistente, più di 2 cadute.
- Utilizzo di risorse: due o più accessi non programmati in ospedale (o strutture di cura specializzate) nel corso dell’ultimo anno per complicanze associate alla malattia cronica. Necessità di cure continuative a casa o presso una struttura residenziale.
- Nelle persone affette da demenza: perdita (non iatrogena) di due o più ADL negli ultimi 6 mesi, difficoltà nella deglutizione, rifiuto del cibo.
In una valutazione longitudinale gli indicatori che, con il loro peggioramento, hanno dimostrato una migliore capacità prognostica sono quelli funzionali e nutrizionali (Amblàs-Novellas et al., 2016).
In una revisione sistematica della letteratura Thomas e colleghi (Thomas et al., 2014)hanno selezionano 33 studi di coorte prospettici pubblicati prima dell’agosto 2010 (28 condotti su anziani ospedalizzati , 5 studi in soggetti istituzionalizzati da almeno 3 mesi o affetti da demenza avanzata, indipendentemente dalla durata dell’istituzionalizzazione) che consentono di identificare le caratteristiche cliniche più fortemente associate con la mortalità ad un anno. Tali caratteristiche sono riferite a sette domini:
- la funzione cognitiva (che include la diagnosi di demenza, le performance cognitive e il delirium);
- la diagnosi della malattia (presenza di comorbilità – Charlson Comorbidity Index e varie malattie singole);
- valori di laboratorio (creatinina ≥1.5, ematocrito <30, conta dei linfociti <1000/mm3, Sodiemia <130 mmol/L);
- stato nutrizionale (BMI; perdita di peso, ipoalbuminemia sierica, deficit nell’assunzione di cibo);
- la funzione fisica (singoli inpairments funzionali e declino funzionale complessivo);
- lesioni da pressione (rischio misurato attraverso scale di valutazione o presenza di lesioni);
- difficoltà di respiro.
Negli studi su pazienti ospedalizzatii domini associati alla mortalità fino a 1 anno, nell’analisi multivariata, erano lo stato nutrizionale (7 studi su 13), la funzione fisica (9 studi su 13), lo stato nutrizionale e la funzione fisica in 6 studi su 13; i domini associati alla mortalità intra ospedaliera erano la funzione fisica, la funzione cognitiva e lo stato nutrizionale. Diagnosi di malattia e valori di laboratorio sono stati associati alla mortalità in analisi multivariata in un numero inferiore di studi e le lesioni da pressione sono state valutate in un numero esiguo di studi per poter effettuare un confronto con gli altri domini.
Negli studi sugli anziani istituzionalizzatila funzione fisica e lo stato nutrizionale erano associati alla mortalità fino a 1 anno nell’analisi multivariata rispettivamente in tutti gli studi e in 4 su 5 studi. La diagnosi di malattia era associata alla mortalità in un numero inferiore di studi, la funzione cognitiva non era associata con la mortalità; le lesioni da decubito e la mancanza di respiro sono state valutate in pochi studi per poter effettuare un confronto con gli altri domini.
Negli studi condotti sugli anziani istituzionalizzatiaffetti da demenzala funzione fisica, le lesioni da pressione e lo stato nutrizionale sono risultati correlati alla mortalità ad un anno più della diagnosi di malattia e delle funzioni cognitive. In questi pazienti la mortalità ad un anno è associata positivamente anche alla difficoltà di respiro (necessità di ossigenoterapia nei precedenti 14gg) e alla presenza di lesioni da pressione >2 stadioNPUAP. Gli autori concludono che gli indicatori dello stato nutrizionale, della funzione fisica e della funzione cognitiva sono più frequentemente associati a mortalità. Questi domini sono facilmente misurabili e possono servire come marker per individuare gli anziani a rischio di mortalità. La Tabella 1 riporta i valori degli indicatori di mortalità rilevati dalla revisione di Thomas e collaboratori.
| Indicatori | Anziani a domicilio | Anziani ospedalizzati | Anziani istituzionalizzati |
| Nutrizionali | Perdita, negli ultimi 6 mesi, di più del 10% del peso. | MNA short form <12
Albumina < 3,5 |
Body Mass Index <22;
Perdita di peso > 5Kg nei 30 giorni precedenti o >10 Kg nei 180 giorni precedenti Presenza di disfagia con più del 25% di alimenti non consumati |
| Stato funzionale | Perdita (non iatrogena) negli ultimi 6 mesi di 2 o più ADL | Barthel index all’ammissione < 65
Dipendenza in >4 ADL |
Dipendenza non iatrogena in tutte le attività di base della vita quotidiana (ADL)
Presenza di incontinenza fecale Confinamento a letto Presenza di uno stato soporoso per la maggior parte della giornata. |
| Funzione cognitiva | Delirium + (DSM-IV)
Mental Status Questionnaire <9 |
Quesito 2: L’utilizzo degli indici prognostici di mortalità migliora l’affidabilità prognostica nel grande anziano?
La revisione sistematica di Yourman (Yourman et al., 2012)analizza la qualità e le limitazioni degli indici prognostici di mortalità negli anziani. Sono stati inclusi tutti gli indici prognostici di mortalità validati nei pazienti la cui età era di 60 anni o più. Sono stati esclusi gli indici prognostici di mortalità specifici per la terapia intensiva, quelli malattia-specifici e quelli specifici per mortalità intraospedaliera. Per ciascun indice prognostico, sono stati considerati i dati sul contesto clinico, potenziali bias, generalizzabilità e accuratezza.
Sono stati esaminati 21.593 lavori per identificare 16 indici che predicono il rischio di mortalità da 6 mesi a 5 anni negli anziani in una varietà di contesti clinici: comunità (6 indici), casa di riposo (2 indici), e ospedale (8 indici). Nessuno studio era libero da potenziali bias. Sebbene 13 indici avessero valori AUC >0,70, nessuno degli indici aveva un valore AUC >0,90. Solo 2 indici prognostici sono stati validati in modo indipendente da ricercatori non coinvolti nello sviluppo dell’indice. Nessun indice era stato testato prospetticamente. Gli autori della revisione concludono affermando che non ci sono prove sufficienti in questo momento per raccomandare l’uso sistematico degli indici prognostici nella pratica clinica.
Thomazeau (Thomazeau et al., 2017)in una successiva revisione della letteratura ha valutato l’efficacia di 22 strumenti nell’individuare il rischio di mortalità (a 3, 6, 12 mesi) in soggetti ospedalizzati in un reparto per acuti di età maggiore o uguale a 65 anni (5 studi), a 70 anni (7 studi), a 75 anni (4 studi) e a 80 anni (1 studio). Gli strumenti selezionati valutano autonomia funzionale, malnutrizione, comorbilità, disturbi cognitivi, motivo dell’ospedalizzazione. Pochi di questi strumenti hanno valori AUC ≥0.70. Gli autori di questa revisione concludono comunque affermando che la disponibilità di uno strumento di valutazione del rischio di mortalità negli anziani ricoverati in un reparto ospedaliero per acuti potrebbe aiutare la gestione di questi pazienti, per orientare meglio l’approccio clinico ed attivare se necessario le cure palliative.
Il Multidimensional Prognostic Index (MPI) è tra gli indici prognostici considerati nella revisione sistematica di Yourman (Yourman et al., 2012)e di Thomazeau (Thomazeau et al., 2017)ed è disponibile in lingua italiana. MPI è uno strumento prognostico di mortalità a 12 mesi costituito da 8 domini con 63 items ricavati dai seguenti strumenti della Valutazione Multidimensionale: Activities of Daily Living (ADL), Instrumental Activities of Daily Living (IADL), Short Portable Mental Status Questionnaire (SPMSQ), Mini Nutritional Assessement (MNA), scala di Exton-Smith per valutare il rischio di lesioni da pressione, Comorbidity Index Rating Scale (CIRS), oltre a numero di farmaci e stato socio-abitativo. MPI è stato costruito utilizzando le informazioni ricavate dall’esecuzione della VMD su una popolazione di anziani (con e senza demenza) ricoverati in ospedale per una patologia acuta o una riacutizzazione di patologia cronica (Pilotto et al., 2008, 2009)e in pazienti non ospedalizzati con deficit cognitivo (Gallucci et al., 2014).
Un’altra revisione della letteratura (Brown et al., 2013)ha preso in considerazione gli indici prognostici di mortalità a 6 mesi nelle persone affette da demenza. E’ noto che l’approccio palliativo può alleviare la sofferenza e fornire cure di fine vita di alta qualità ai pazienti affetti da demenza, ma tale approccio è spesso loro negato dal mancato riconoscimento della demenza come malattia terminale (Mitchell et al., 2004).Di fatto, nonostante tali pazienti abbiano livelli di bisogno di cure palliative simili a quelli dei malati terminali di cancro, hanno meno probabilità di essere indirizzati alle cure palliative e che siano loro prescritti farmaci a scopo palliativo.
La revisione di Brown ha incluso 7 articoli, di cui 2 riferiti all’hospice, 2 a strutture residenziali per anziani e 3 a strutture di lungodegenza: tutti gli studi sono concordi nell’affermare la necessità di includere, quale criterio prognostico di mortalità a 6 mesi, una misura della gravità della demenza, ma non vi è consenso sulla scala migliore da utilizzare. Sei studi sui sette esaminati hanno rilevato che il Functional Assessment STaging scale (FAST) (Reisberg, 1988), attualmente utilizzato negli Stati Uniti, non è un predittore affidabile della mortalità a 6 mesi. La limitazione della scala FAST è legata al fatto che tale strumento presuppone una progressione lineare della malattia e quindi esclude tutti i pazienti nei quali la progressione della demenza non è lineare soprattutto per l’effetto della comorbilità. Inoltre, la FAST potrebbe non essere valida per i pazienti con demenza non Alzheimer. Tra gli altri indici l’Advanced Dementia Prognostic Tool (ADEPT) (Mitchell et al., 2010)ha una moderata capacità prognostica per la mortalità a 6 mesi, con elevata concordanza, discreta discriminazione e alta sensibilità (> 90%), ma una bassa specificità (30%). Gli autori concludono indicando la necessità di ulteriori studi per identificare indici prognostici diversi per la demenza avanzata, così da isolare in modo più definitivo i fattori che si applicano specificamente alle persone negli stadi finali della demenza.
La revisione sistematica di Rikkert (Rikkert et al., 2011)si è posta l’obiettivo di indagare l’affidabilità, la validità e la fattibilità delle scale di stadiazione clinicamente applicabili per la demenza come sindrome e per la demenza di Alzheimer come entità più specifica di malattia. Sono stati individuati 963 articoli, di cui 23 (2,4%) hanno soddisfatto tutti i criteri di inclusione ed esclusione: negli articoli selezionati è stato possibile identificare 12 diversi strumenti di staging sviluppati a partire dagli anni 80 del secolo scorso. La Clinical Dementia Rating Scale (CDR) è la scala con le migliori evidenze, studiata in prospettiva internazionale e tradotta in 14 lingue: sebbene non sia disponibile lo studio di validazione della traduzione in lingua italiana la CDR è ampiamente utilizzata nel nostro paese. Nelle fasi avanzate della demenza, la grande maggioranza delle scale di valutazione delle funzioni cognitive e delle performance funzionali perdono la propria sensibilità nell’identificare ulteriori progressioni della malattia: la versione estesa della CDR (Dooneief et al, 1996) prevede due ulteriori stadi, CDR 4 (demenza grave) e CDR 5 (demenza terminale), ai quali è associata una soppravivenza media rispettivamente di 24 e 12 mesi.
La Bedford Alzheimer Nursing Severity Scale (BANS-S) è in grado di differenziare le condizioni cognitive e funzionali dei soggetti con demenza avanzata (Rikkert et al., 2011). Lo strumento combina la valutazione dei deficit cognitivi (linguaggio, contatto visivo) e funzionali (vestirsi, mangiare, deambulare) con l’insorgenza di sintomi patologici (disturbi del ciclo sonno-veglia, rigidità/ contratture muscolari) ed è stato testato su tre unità residenziali per persone affette da demenza (Volicer et al, 1994). La versione italiana (Bellelli et al., 1997)è stata validata su 99 persone affette da demenza (81 femmine e 18 maschi di età compresa tra i 55 e i 100 anni) istituzionalizzate. Rispetto ad altri test di valutazione, che nel 40% dei soggetti ottenevano un effetto pavimento, la BANS-S e la CDR versione estesa hanno mostrato una distribuzione più uniforme dei punteggi nell’intero intervallo possibile. La validità convergente di BANS-s con le altre scale cognitive (MMSE) e funzionali (ADL di Katz e Tinetti Balance & Gait) era buona, con Pearson che variava da 0,62 a 0,79.
| RACCOMANDAZIONE 1: Valutare periodicamente, nell’ambito della valutazione multidimensionale geriatrica, gli indicatori nutrizionali, lo stato funzionale e la funzione cognitiva. Il progressivo peggioramento aumenta il rischio di mortalità a 12 mesi. Sono richiesti ulteriori studi per stabilire se l’utilizzo routinario di indici prognostici basati sulla valutazione multidimensionale geriatrica possa migliorare la gestione clinica della persona |
| RACCOMANDAZIONE 2: Utilizzare negli anziani affetti da demenza la Clinical Dementia Rating Scale e/o la Bedford Alzheimer Nursing Severity Scale (BANS-S). Il loro utilizzo migliora l’affidabilità prognostica. |
Quesito 3: Gli strumenti di valutazione del bisogno di cure palliative sono affidabili nell’identificare il bisogno di cure palliative nel grande anziano?
Nel grande anziano affetto da (poli)patologia cronica non tumorale è importante individuare precocemente la necessità di passare da un approccio terapeutico a quello palliativo e di sostituire l’obiettivo di prolungare la vita massimizzando le capacità funzionali con quello di assicurare alla persona il massimo comfort. La disponibilità di strumenti in grado di identificare il bisogno di cure palliative potrebbe aiutare a garantire le cure migliori a questi pazienti sia al loro domicilio che nelle strutture residenziali o, al momento del ricovero in ospedale, nei dipartimenti di emergenza.
Valutazione del bisogno di cure palliative negli anziani nelle cure primarie
Due gruppi di autori (Maas et al., 2013; Walsh et al., 2015) hanno condotto separatamente una revisione sistematica della letteratura internazionale per valutare gli strumenti utilizzati nelle cure primarie – rispettivamente in Europa ed in Australia – per identificare i pazienti con esigenze di cure palliative (Maas e colleghi in Europa e Walsh e colleghi in Australia).
Attraverso la revisione sistematica della letteratura Maas e colleghi hanno reperito quattro strumenti di valutazione del bisogno di cure palliative:
- RADboud indicators for PAlliative Care needs (RADPAC) (Thoonsen et al., 2012)
- Residential home palliative care tool (Grbich et al., 2005))
- Supportive and Palliative Care Indicators Tool (SPICT) (Boyd & Murray, 2015)
- Early identification tool for palliative care patients (Rainone et al., 2007).
Gli stessi autori, per identificare eventuali altri strumenti utilizzati nella pratica clinica, hanno inviato un questionario ai medici di medicina generale componenti la Taskforce dell’ Associazione europea per le cure palliative – EAPC in Primary Care, oggi denominata EAPC Primary Care Reference Group – che nel 2012 (anno in cui è stato realizzato lo studio) era rappresentativa di 14 paesi europei (Albania, Armenia, Belgio, Danimarca, Germania, Irlanda, Lussemburgo, Malta, Paesi Bassi, Portogallo, Serbia, Spagna, Svizzera e Regno Unito).
Grazie al questionario, compilato dai rappresentanti di tutti i 14 paesi europei (otto hanno dichiarato che non esistevano strumenti di identificazione nel loro paese) sono stati individuari ulteriori tre strumenti:
- Prognostic Indicator Guide (PIG) sviluppato in Inghilterra e basato sul Gold Standard Framework goldstandardsframework.nhs.uk
- NECPAL-CCOMS-ICO sviluppato in Spagna (Gómez-Batiste et al., 2013)
- A QUICK GUIDE to Identifying Patients for Supportive and Palliative Care sviluppato in Inghilterra (McDaid, 2011).
Quattro strumenti già riportati nel lavoro di Maas sono stati individuati anche dalla revisione della letteratura operata da Walsh e colleghi: Prognostic Indicator Guide (PIG) , NECPAL-CCOMS-ICO, Supportive and Palliative Care Indicators Tool (SPICT) e RADboud indicators for PAlliative Care needs (RADPAC). La domanda sorprendete (SQ) è utilizzata da tutti gli strumenti individuati tranne RADPAC e SPICT. Il RADPAC è specifico per un numero limitato di malattie: cancro, BPCO e scompenso di cuore. Tutti gli strumenti contengono indicatori di declino generali, come ricoveri ospedalieri ripetuti o prolungati, perdita di peso e diminuzione dello stato funzionale. Gli strumenti correlati tra loro (NECPAL-CCOMS- ICO, SPICT e PIG) riassumono ampiamente gli indicatori di decadimento specifici per malattia per un certo numero di condizioni. In tutti gli strumenti, l’inclusione di indicatori psicologici, sociali o spirituali sono limitati. RADPAC descrive il criterio del “sentire che si avvicina la fine della vita”. Nessuno dei sette strumenti di valutazione del bisogno di cure palliative è stato validato o ampiamente implementato. Mass e colleghi concludono affermando che la loro revisione documenta i crescenti tentativi di attuare le indicazioni dell’OMS, secondo la quale sono necessarie sia l’identificazione precoce dei pazienti che hanno bisogno di cure palliative sia l’estensione di tali cure a tutte le condizioni cliniche.
Anche studi successivi su alcuni degli strumenti identificati dai due autori nelle loro revisioni di letteratura, non raggiungono livelli di evidenza sufficienti per raccomandarne l’utilizzo di routine:
- il Gold Standards Framework (GSF) con il Prognostic Indicator Guidance (PIG) è stato studiato in un solo lavoro (O’Callaghan et al., 2014)su una popolazione di 501 pazienti ricoverati di tutte le età e i risultati sono dubbi;
- il Supportive and Palliative Care Indicators Tool (SPICT) è stato recentemente validato su una popolazione di pazienti anziani (84aa) attraverso uno studio (De Bock et al., 2017)che ha dimostrato un’associazione significativa con la mortalità ad un anno (sensibilità di 0,841 e specificità di 0,579) e con le previsioni di sopravvivenza di geriatri esperti. Poiché i geriatri esperti sono stati in grado di identificare la maggior parte dei pazienti con prognosi limitata in base alle loro abilità cliniche, il valore aggiunto di SPICT in un reparto geriatrico per acuti può essere messo in discussione. Il valore aggiunto di SPICT in altri reparti ospedalieri e nell’assistenza primaria deve essere ulteriormente studiato;
- il NECesidades PALiativas CCOMS-ICO tool (NECPAL CCOMS-ICO tool) che combina la SQ con indicatori aggiuntivi, è stato validato (Amblàs-Novellas et al., 2016)in un’ampia popolazione di soggetti ultra 65enni anche istituzionalizzati. L’accuratezza prognostica di SQ e NECPAL è di 52,9% e 55,2% rispettivamente, e la sua utilità prognostica deve essere applicata con cautela. Sono necessarie ulteriori ricerche, attualmente in corso, per migliorare ulteriormente la capacità prognostica dello strumento NECPAL, combinato con altri parametri, per aumentare la specificità e ridurre i falsi positivi.
Nonostante questi limiti secondo Maas e colleghi i medici di medicina generale dovrebbero essere incoraggiati a usare la loro esperienza clinica e uno degli strumenti esistenti per identificare precocemente i pazienti che potrebbero giovarsi di un approccio palliativo, come primo passo per migliorare la qualità della vita dei pazienti che attualmente vivono e muoiono con bisogni di assistenza palliativa non soddisfatti perchè non riconosciuti.
A loro volta Walsh e colleghi sottolineano la necessità che gli strumenti di identificazione precoce siano facili da utlilizzare e accessibili ad una vasta gamma di clinici indipendentemente dalla loro particolare esperienza e competenza in cure palliative.
Valutazione del bisogno di cure palliative negli anziani istituzionalizzati
Partendo dal presupposto che la valutazione multidimensionale geriatrica (VMD) può migliorare l’accuratezza diagnostica, ottimizzare il trattamento, migliorare la prognosi, ripristinare e massimizzare la funzionalità, migliorare la qualità della vita e ridurre i costi, Hermans e colleghi (Hermans et al., 2014)hanno condotto una revisione della letteratura riferita alle strutture residenziali per anziani per identificare tutti gli strumenti per la valutazione del bisogno di cure palliative basati sulla VMD e validati. Per ognuno degli strumenti individuati sono state valutate le proprietà psicometriche e la completezza dei contenuti utilizzando come parametro di riferimento i 13 aspetti proposti dall’Australian Government Department of Health and Ageing (AGDHA) per l’approccio palliativo agli anziani istituzionalizzati: modelli di cura e pratiche di cura, strumenti di valutazione e gestione, comorbilità, deficit cognitivo, cura fisica, supporto psicosociale, supporto spirituale, supporto alla famiglia, attenzione alle minoranze etniche, supporto culturale, direttive avanzate, dignità e qualità della vita, aspetti locali di contesto.
La revisione sistematica ha identificato cinque strumenti per la valutazione del bisogno di cure palliative validati negli anziani istituzionalizzati:
- Missoula-VITAS Quality of Life Index – Revised (MVQOLI –R) (Schwartz et al., 2005)
- Modified Quality of Life Concerns in the End of Life Questionnaire (mQOLC-E) (Chan & Pang, 2008)
- McMaster Quality of Life Scale (MQLS) (Sterkenburg et al., 1996)
- interRAI Palliative Care instrument (interRAI PC) (Hirdes et al., 2008)
- Palliative care Outcome Scale (POS) (Brandt et al., 2005; Siegert et al., 2010)
Da un punto di vista psicometrico, il MQLS è stato validato più accuratamente rispetto agli altri strumenti. Tuttavia, lo strumento per le cure palliative valutato come il più completo in termini di contenuto è interRAI PC.
Il primo – MQLS – sviluppato presso la McMaster University in Canada, è uno strumento composto da 32 domande e include sintomi fisici, stato funzionale, funzionamento sociale, stato emotivo, stato cognitivo, sonno e riposo, energia e vitalità, soddisfazione generale della vita e significato della vita. I risultati della ricerca suggeriscono che il MQLS ha buone proprietà psicometriche. Il MQLS mostra una buona coerenza interna (α=0,80), un’elevata affidabilità intra-valutatore (r≥0,83) e un’affidabilità inter-valutatore moderata (r≥0,55). Come ipotizzato, i punteggi ottenuti intervistando il soggetti sono inferiori ai punteggi ottenuti con l’auto-compilazione (t=1,83, p=0,04). Lo strumento è stato convalidato con l’indice Spitzer Quality of Life (SQLI). Il MQLS dello staff era altamente correlato con lo SQLI (r=0.70) mentre la correlazione con lo stesso indice era moderata (r=0.50) per la valutazione del paziente. Questi risultati mostrano prove di validità concomitante. Inoltre, la scala è sensibile al cambiamento delle condizioni del paziente. Lo strumento è affidabile e valido per valutare la qualità della vita durante il periodo delle cure palliative e comprende 9 dei 13 aspetti rilevanti proposti dall’ AGDHA. Inoltre, il MQLS valuta la qualità della vita dal punto di vista della persona che è la miglior fonte di informazioni sulla propria qualità di vita.
La multinazionale di ricerca InterRAI (www.interRAI.org) ha sviluppato la suite di strumenti interRAI (assistenza a lungo termine, assistenza domiciliare, salute mentale, disabilità intellettiva, cure acute, cure palliative, ecc.) per sostenere la valutazione e la pianificazione dell’assistenza agli anziani, nei servizi di salute mentale e nei servizi per le persone con disabilità.
Ogni strumento interRAI include un questionario, costituito da domande sul contesto assistenziale del cliente. I risultati sono calcolati mediante algoritmi validati a livello internazionale. Esempi di risultati sono i CAP (protocolli di valutazione del cliente), e i QI (indicatori di qualità). Sulla base di questi risultati, i piani di assistenza individuale possono essere valutati e adeguati.
La suite di strumenti interRAI migliora il trasferimento di informazioni tra gli operatori sanitari e le strutture sanitarie per garantire la continuità delle cure. Inoltre, la ricerca ha dimostrato che la suite di strumenti interRAI può migliorare la qualità dell’assistenza nelle strutture residenziali e migliorare gli outcome. Lo strumento interRAI per le cure palliative (interRAI PC) è uno strumento di valutazione olistico e standardizzato per valutare i bisogni e le preferenze delle persone con necessità di cure palliative in tutte le situazioni. Lo strumento si articola in 74 item ed è diviso in 17 sezioni. E’validato per i residenti delle case di riposo con esigenze di cure palliative. Nonostante il numero di item, lo strumento richiede solo 20 minuti per completarlo. Il PC interRAI è stato valutato in due popolazioni, tra cui i residenti con esigenze di cure palliative. L’affidabilità inter-valutatore era maggiore di 0,77 in tutti i domini (media Kappa=0,83). Il valore di Kappa era pari a 0,80 o superiore per circa il 50% delle domande. Tuttavia, in questi lavori non sono stati riportati dati su altre proprietà psicometriche del PC interRAI. L’ultima versione di interRAI PC (versione 9.1) comprende tutti i 13 aspetti rilevanti proposti dall’AGDHA per un approccio palliativo negli anziani istituzionalizzati.
In Belgio, la suite di strumenti interRAI può essere compilata su un’applicazione web online gratuita (belrai.org) con accesso riservato. InterRAI è disponibile anche in italiano ma è necessario l’acquisto della licenza e del software.
Valutazione del bisogno di cure palliative negli anziani nei servizi di emergenza
Anche i servizi di emergenza si occupano frequentemente di grandi anziani in cui eventi clinici acuti anche catastrofici si sovrappongono a condizioni catterizzate da polipatologia, fragilità e disabilità. La presa in carico da parte del Dipartimento di Emergenza (DE) può rappresentare un’opportunità preziosa per individuare la necessità di cure palliative ed indirizzare i pazienti ai servizi specifici. Nel DE l’approccio palliativo aiuta a focalizzare l’attenzione sulla qualità della vita, allineando così gli obiettivi di cura della persona con la gestione ed evitando interventi e ricoveri ospedalieri inappropriati. La revisione sistematica di George e colleghi (George et al., 2016)ha identificato sette studi che proponevano criteri o strumenti per valutare il bisogno di cure palliative nelle persone afferenti ai dipartimenti di emergenza. Quattro studi erano riferiti a persone anziane (>64 anni) con una condizione clinica avanzata (Glajchen et al., 2011) con più malattie croniche (Mahony et al., 2008), a rischio di ripetuti accessi a servizi per l’emergenza urgenza (Mion et al., 2001), con una demenza avanzata (Ouchi et al., 2014). Glajchen, O’Mahony e Mion hanno utilizzato una valutazione su due livelli: una valutazione iniziale – effettuata da parte di un infermiere di triage (Glajchen et al., 2011), da un infermiere con competenze avanzate nell’assistenza agli anziani (Mahony et al., 2008)o da un’assistente sociale (Mion et al., 2001) – e una valutazione più dettagliata da parte di un case manager. Gli autori di questa revisione sistematica concludono confermando la necessità di una valutazione del bisogno di cure palliative nelle persone che afferiscono al dipartimento di emergenza attraverso un processo strutturato su due livelli. L’infermiere di triage potrebbe effettuare la valutazione iniziale con un algoritmo semplice che non richiede idealmente più di 1-2 minuti aggiuntivi e utilizza i dati raccolti nel processo di triage. I criteri utilizzati dall’algoritmo potrebbero variare in relazione al target: anziani residenti a domicilio o istituzionalizzati. Quei pazienti che ottengono un risultato ”positivo” potrebbero avere una valutazione di secondo livello con strumenti che valutano gli aspetti funzionali, sociali, i sintomi e il burden dei caregiver. Questo livello di valutazione può essere meglio eseguito da personale qualificato.
| RACCOMANDAZIONE 3: Utilizzare sistematicamente uno strumento di valutazione del bisogno di cure palliative. Il loro utilizzo migliora in tutti i setting l’identificazione delle persone che necessitano di un approccio palliativo. |
Ritorna alla scheda informativa della Conferenza di Consenso
Bibliografia
Amblàs-Novellas, J., Murray, S. A., Espaulella, J., Martori, J. C., Oller, R., Martinez-Muñoz, M., … Gómez-Batiste, X. (2016). Identifying patients with advanced chronic conditions for a progressive palliative care approach: a cross-sectional study of prognostic indicators related to end-of-life trajectories. BMJ Open, 6(9), e012340.
Baronner, A., & MacKenzie, A. (2017). Using Geriatric Assessment Strategies to Lead End-of-Life Care Discussions. Current Oncology Reports, 19(11).
Bellelli, G., Frisoni, G. B., Bianchetti, A., & Trabucchi, M. (1997). Bellelli et al Am J of Alz Disease & other Dementias 1997.pdf. American Journal of Alzheimer’s Disease and Other Dementias, 11(2), 71–77.
Boyd, K. J., & Murray, S. A. (2015). Worsening disability in older people: a trigger for palliative care. BMJ: British Medical Journal, 350:h2439
Brandt, H. E., Deliens, L., van der Steen, J. T., Ooms, M. E., Ribbe, M. W., & van der Wal, G. (2005). The last days of life of nursing home patients with and without dementia assessed with the palliative care outcome scale. Palliative Medicine, 19(4), 334–342.
Brown, M. A., Sampson, E. L., Jones, L., & Barron, A. M. (2013). Prognostic indicators of 6-month mortality in elderly people with advanced dementia: A systematic review. Palliative Medicine, 27(5), 389–400.
Cardona-Morrell, M., Lewis, E., Suman, S., Haywood, C., Williams, M., Brousseau, A. A., … Dent, E. (2017). Recognising older frail patients near the end of life: What next? European Journal of Internal Medicine, 45, 84–90.
Chan, H., & Pang, S. (2008). Applicability of the modified Quality-of-Life Concerns in the End of Life Questionnaire (mQOLC-E) for frail older people. Asian J Gerontol Geriatr, 3(1), 17–26.
Cimino, N. M., & McPherson, M. L. (2014). Evaluating the Impact of Palliative or Hospice Care Provided in Nursing Homes. Journal of Gerontological Nursing, 40(10), 10–14.
Clegg, A., Young, J., Iliffe, S., Olde Rikkert, M. G. M., & Rockwood, K. (2013). Frailty in older people. Lancet, 381(9868), 752–762.
De Bock, R., Van Den Noortgate, N., & Piers, R. (2018). Validation of the Supportive and Palliative Care Indicators Tool in a Geriatric Population. Journal of Palliative Medicine, 21(2), 220-224, jpm.2017.0205.
Ellis, G., Gardner, M., Tsiachristas, A., Langhorne, P., Burke, O., Rh, H., … Shepperd, S. (2017). Comprehensive geriatric assessment for older adults admitted to hospital ( Review ). Cochrane Database of Systematic Reviews, Sep 12(9), 1–108.
Gallucci, M., Battistella, G., Bergamelli, C., Spagnolo, P., Mazzuco, S., Carlini, A., … Pilotto, A. (2014). Multidimensional prognostic index in a cognitive impairment outpatient setting: Mortality and hospitalizations. the treviso dementia (TREDEM) study. Journal of Alzheimer’s Disease, 42(4), 1461–1468.
George, N., Phillips, E., Zaurova, M., Song, C., Lamba, S., & Grudzen, C. (2016). Palliative care screening and assessment in the emergency department: A systematic review. Journal of Pain and Symptom Management, 51(1), 108–119.e2.
Glajchen, M., Lawson, R., Homel, P., Desandre, P., & Todd, K. H. (2011). A rapid two-stage screening protocol for palliative care in the emergency department: A quality improvement initiative. Journal of Pain and Symptom Management, 42(5), 657–662.
Gómez-Batiste, X., Martínez-Muñoz, M., Blay, C., Amblàs, J., Vila, L., Costa, X., … Constante, C. (2013). Identifying patients with chronic conditions in need of palliative care in the general population: Development of the NECPAL tool and preliminary prevalence rates in Catalonia. BMJ Supportive & Palliative Care, 3(3), 300–308.
Grbich, C., Maddocks, I., Parker, D., Brown, M., Willis, E., Piller, N., & Hofmeyer, A. (2005). Identification of patients with noncancer diseases for palliative care services. Palliative and Supportive Care, 3(1), 5–14.
Hall, S., Davies, E., Frogatt, K., Higginson, I., & Kolliakou, A. (2008). Interventions for improving palliative care for older people living in nursing care homes. Cochrane Database of Systematic Reviews, (2).
Hermans, K., De Almeida Mello, J., Spruytte, N., Cohen, J., Van Audenhove, C., & Declercq, A. (2014). A comparative analysis of comprehensive geriatric assessments fornursing home residents receiving palliative care: A systematic review. Journal of the American Medical Directors Association, 15(7), 467–476.
Hirdes, J. P., Ljunggren, G., Morris, J. N., Frijters, D. H., Finne Soveri, H., Gray, L., … Gilgen, R. (2008). Reliability of the interRAI suite of assessment instruments: A 12-country study of an integrated health information system. BMC Health Services Research, 8, 1–11
Kulmala, J., Nykänen, I., Mänty, M., & Hartikainen, S. (2013). Association between frailty and dementia: A population-based study. Gerontology,60(1), 16–21.
Lunney, J. R., Lynn, J., Foley, D. J., & Lipson, S. (2003). At the End of Life, 289(18), 2387–2392.
Maas, E. A. T., Murray, S. A., Engels, Y., & Campbell, C. (2013). What tools are available to identify patients with palliative care needs in primary care: A systematic literature review and survey of European practice. BMJ Supportive & Palliative Care, 3(4), 444–451.
McDaid, P. (2011). A QUICK GUIDE to Identifying Patients for Supportive and Palliative Care Look for two or more of the following. Framework,10, 2.
Mion, L. C., Palmer, R. M., Anetzberger, G. J., & Meldon, S. W. (2001). Establishing a case-finding and referral system for at-risk older individuals in the emergency department setting: The SIGNET model. Journal of the American Geriatrics Society, 49(10), 1379–1386.
Mitchell, S. L., Kiely, D. K., Hamel, M. B., R, B., M, G., GE, S., … AM, T. (2004). Dying With Advanced Dementia in the Nursing Home. Archives of Internal Medicine, 164(3), 321.
Mitchell, S. L., Miller, S. C., Teno, J. M., Davis, R. B., & Shaffer, M. L. (2010). The Advanced Dementia Prognostic Tool (ADEPT): A Risk Score to Estimate Survival in Nursing Home Residents with Advanced Dementia. J Pain Symptom Manage, 40(5), 639–651.
Murray, S. A., Kendall, M., Boyd, K., & Sheikh, A. (2005). Illness trajectories and palliative care. BMJ: British Medical Journal,330(7498), 1007–1011.
O’Callaghan, A., Laking, G., Frey, R., Robinson, J., & Gott, M. (2014). Can we predict which hospitalised patients are in their last year of life? A prospective cross-sectional study of the Gold Standards Framework Prognostic Indicator Guidance as a screening tool in the acute hospital setting. Palliative Medicine, 28(8), 1046–1052.
O’Mahony, S., Blank, A., Simpson, J., Persaud, J., Huvane, B., McAllen, S., … Selwyn, P. (2008). Preliminary report of a palliative care and case management project in an emergency department for chronically ill elderly patients. Journal of Urban Health, 85(3), 443–451.
Ouchi, K., Wu, M., Medairos, R., Grudzen, C. R., Balsells, H., Marcus, D., … Liberman, T. (2014). Initiating Palliative Care Consults for Advanced Dementia Patients in the Emergency Department. Journal of Palliative Medicine, 17(3), 346–350.
Panza, F., Solfrizzi, V., Lozupone, M., Barulli, M. R., D’Urso, F., Stallone, R., … Logroscino, G. (2018). An Old Challenge with New Promises: A Systematic Review on Comprehensive Geriatric Assessment in Long-Term Care Facilities. Rejuvenation Research, 21(1),3-14. rej.2017.1964.
Pilotto, A., Cella, A., Pilotto, A., Daragjati, J., Veronese, N., Musacchio, C., … Panza, F. (2017). Three Decades of Comprehensive Geriatric Assessment: Evidence Coming From Different Healthcare Settings and Specific Clinical Conditions. Journal of the American Medical Directors Association,18(2), 192.e1-192.e11.
Pilotto, A., Ferrucci, L., Franceschi, M., D’Ambrosio, L. P., Scarcelli, C., Cascavilla, L., … Leandro, G. (2008). Development and Validation of a Multidimensional Prognostic Index for One-Year Mortality from Comprehensive Geriatric Assessment in Hospitalized Older Patients. Rejuvenation Research, 11(1), 151–161.
Pilotto, A., Sancarlo, D., Panza, F., Paris, F., D’Onofrio, G., Cascavillaa, L., … Solfrizzi, V. (2009). The Multidimensional Prognostic Index (MPI), Based on a Comprehensive Geriatric Assessment, Predicts Short- and Long- Term Mortality in Hospitalized Older Patients with Dementia. Journal of Alzheimers Disease, 18(1), 191–199.
Rainone, F., Blank, A., & Selwyn, P. A. (2007). The Early Identification of Palliative Care Patients : Preliminary Processes and Estimates From Urban Family Medicine Practices. American Journal of Hospice & Palliative Medicine, 24(2), 137–140.
Rikkert, M. G., Tona, K. D., Janssen, L., Burns, A., Lobo, A., Robert, P., … Waldemar, G. (2011). Validity, Reliability, and Feasibility of Clinical Staging Scales in Dementia. American Journal of Alzheimer’s Disease & Other Dementias, 26(5), 357–365.
Schwartz, C. E., Merriman, M. P., Reed, G., & Byock, I. (2005). Evaluation of the Missoula-VITAS Quality of Life Index—Revised: Research Tool or Clinical Tool? Journal of Palliative Medicine, 8(1), 121–135.
Siegert, R. J., Gao, W., Walkey, F. H., & Higginson, I. J. (2010). Psychological well-being and quality of care: A factor-analytic examination of the palliative care outcome scale. Journal of Pain and Symptom Management, 40(1), 67–74.
Sterkenburg, C. A., King, B., & Woodward, C. A. (1996). A reliability and validity study of the McMaster Quality of Life Scale (MQLS) for a palliative population. Journal of Palliative Care, 12(1), 18–25.
Swagerty, D. (2017). Integrating Quality Palliative and End-of-Life Care into the Geriatric Assessment: Opportunities and Challenges. Clinics in Geriatric Medicine, 33(3), 415–429.
Thomas, J. M., Cooney, L. M. J., & Fried, T. R. (2014). Systematic Review: Health-related Characteristics of Elderly Hospitalized Patients and Nursing Home Residents Associated with Short-term Mortality. Journal of the American Geriatrics Society, 61(6), 902–911.
Thomazeau, J., Huo Yung Kai, S., Rolland, Y., Sourdet, S., Saffon, N., & Nourhashemi, F. (2017). Repérage du haut risque de mortalité durant la première année qui suit une hospitalisation en médecine aiguë chez les patients de plus de 65 ans : revue de la littérature. Presse Medicale, 46(4), 360–373.
Thoonsen, B., Engels, Y., Van Rijswijk, E., Verhagen, S., Van Weel, C., Groot, M., & Vissers, K. (2012). Early identification of palliative care patients in general practice: development of RADboud indicators for PAlliative Care Needs (RADPAC). British Journal of General Practice,62(September), e625–e631.
Ticinesi, A., Nouvenne, A., Lauretani, F., Prati, B., Cerundolo, N., Maggio, M., & Meschi, T. (2016). Survival in older adults with dementia and eating problems: To PEG or not to PEG? Clinical Nutrition,35(6), 1512–1516.
Walsh, R., Mitchell, G., Francis, L., & van Driel, M. (2015). What diagnostic Tools exist for early identification of palliative patients in general practice – a systematic review. Journal of Palliative Care, 31(2), 118–125.
Yourman, L. C., Lee, S. J., Schonberg, M. A., Widera, E. W., & Smith, A. K. (2012). Prognostic Indices for Older Adults A Systematic Review. JAMA – Journal of the American Medical Association, 307(2), 182–192.
Note:
[1]National Clinical Guideline Centre (UK).The prevention and management of pressure ulcers in primary and secondary care. London: National Institute for Health and Care Excellence (UK), 2014.
Ritorna alla scheda informativa della Conferenza di Consenso
GLI INTERVENTI PALLIATIVI NEL GRANDE ANZIANO
La discussione sulla pianificazione anticipata delle cure
Pierangelo Lora Aprile
Razionale
La recente evoluzione delle cure palliative dall’end-of-life care alla precoce identificazione della necessità di cure palliative pone il problema della comunicazione e del consenso per la pianificazione anticipata delle cure.
La discussione sulla pianificazione delle cure è un’espressione generica utilizzata per descrivere la comunicazione tra i curanti e i pazienti e/o i loro fiduciari sugli obiettivi e i desideri della persona. La discussione ha forme e modalità diverse e può essere avviata in una vasta gamma di circostanze. La consapevolezza che la fine della propria vita si sta avvicinando potrebbe essere un prerequisito per affrontare il tempo che resta da vivere con maggiore serenità e in definitiva arrivare a quella che si definisce una “buona morte”.
La pianificazione anticipata delle cure è il processo che consente agli individui, ai loro familiari e ai curanti di sviluppare una comprensione condivisa della condizione di salute e delle potenziali esigenze di assistenza futura e permette all’individuo di esprimere le preferenze per le cure future. È necessario precisare che l’informazione non può identificarsi con la consapevolezza obiettiva, certa e piena della prognosi poiché vi sono dubbi per gli stessi operatori sanitari nel caso di “grandi anziani” in cui l’evoluzione delle malattie croniche in molti casi è incerta. Il fine ultimo che gli operatori si prefiggono con i colloqui con la persona e la sua famiglia non è la comunicazione della prognosi, ma l’accompagnamento all’interno di un “ambiente di verità” in cui sia possibile partecipare alle decisioni, condividere alcune scelte sulla base delle preferenze e dei desideri personali.
Il metodo proposto per la discussione sulla pianificazione delle cure è la cosiddetta “comunicazione progressiva”. La consapevolezza, infatti, non è un elemento stabile, risente di innumerevoli fattori personali, psicologici, familiari, sociali, culturali e religiosi e si manifesta in una “narrazione” soggettiva ed individuale dalla quale non si deve prescindere, nel rispetto della dignità personale: occorre, pertanto, “entrare a far parte” del racconto della storia personale della persona, per poter iniziare a comunicare con semplicità e chiarezza, instaurando prima possibile un clima di fiducia e responsabilità utile per sviluppare un piano di cure condiviso con la persona e, se possibile, con le persone per lui significative (Informazione e consenso progressivo in Cure Palliative: un processo evolutivo condiviso” – Raccomandazioni della SICP: www.sicp.it)
Quesito 4: La discussione sul fine vita e la pianificazione anticipata delle cure migliorano la concordanza tra le preferenze della persona e le cure di fine vita ricevute ?
Nei decenni precedenti, la pianificazione anticipata delle cure era spesso considerata sinonimo di espressione delle direttive anticipate di trattamento; oggi la pianificazione anticipata delle cure è il processo attraverso il quale i pazienti discutono con i curanti, i familiari e altre persone a loro care ed esprimono le loro scelte rispetto ai trattamenti di fine vita (Singer et al., 1996).
Secondo una recente Consensus Conference Internazionale (Rietjens et al., 2017) la pianificazione anticipata delle cure consente alle persone con capacità decisionale di identificare i propri valori, di riflettere sui significati e sulle conseguenze di scenari di malattia grave, definire obiettivi e preferenze per futuri trattamenti e cure mediche e discuterne con i familiari e gli operatori sanitari. La pianificazione anticipata delle cure affronta le preoccupazioni degli individui in tutti i campi fisico, psicologico, sociale e spirituale. Incoraggia le persone a identificare un rappresentante personale e a registrare e rivedere periodicamente le proprie preferenze, affinchè siano prese in considerazione anche qualora non vi fosse più la capacità di prendere decisioni.
La revisione di Sharp (Sharp et al., 2013)si concentra sulle conversazioni in merito all’assistenza di fine vita con le persone fragili e anziane che non hanno una diagnosi prevalente, spesso associata a molteplici comorbidità e compromissione cognitiva, e che si stima rappresentino circa il 40% dei decessi. La revisione ha identificato gli ostacoli alle discussioni sul fine vita con le persone anziane fragili che non si sono riscontrati negli studi su altre popolazioni, compresa la riluttanza dei membri della famiglia a discutere delle cure di fine vita, l’attesa passiva che altri hanno deciso a loro nome e l’incertezza riguardante la prognosi. Gli autori concludono che sebbene la maggior parte degli anziani desideri un’opportunità per discutere delle cure di fine vita, solo a una minoranza viene data quest’opportunità.
L’European Association for Palliative Care (EAPC) raccomanda che anche nelle persone affette da demenza il processo decisionale sia condiviso con la persona e con la sua famiglia: ciò implica che dovrebbe iniziare non appena viene formulata la diagnosi, quando la persona può ancora essere attivamente coinvolta ed esprimere le sue preferenze, i suoi valori, i suoi bisogni (Van Der Steen et al., 2014).
L’efficacia della pianificazione anticipata delle cure è stata indagata in più studi: Houben (Houben, et al., 2014)nella sua revisione conclude affermando che la pianificazione anticipata delle cure in diverse popolazioni di pazienti adulti e anziani affetti da patologie croniche migliora la concordanza tra le preferenze del paziente per le cure di fine vita e le cure di fine vita ricevute; Brinkman-Stoppelenburg (Brinkman-Stoppelenburg et al. 2014)ha osservato una riduzione delle opedalizzazioni, spesso inutili e traumatiche, dei soggetti fragili istituzionalizzati e Graverholt (Graverholt et al., 2014)un aumento significativo del numero di residenti che muoiono in casa di riposo.
| RACCOMANDAZIONE 4: Discutere la pianificazione delle cure di fine vita con la persona e la sua famiglia: ciò migliora la concordanza tra le preferenze espresse e le cure ricevute. |
Assistenza infermieristica palliativa
Ermellina Zanetti, Cinzia Bertelli, Simonetta Di Meo, Serena Sperotto
Le cure palliative possono essere difficili da articolare. Non si tratta di un ambito assistenziale (come la terapia intensiva, la riabilitazione, l’hospice) o di un programma di gestione della condizione di malattia, ma piuttosto di una filosofia di cura e di un sistema organizzato e altamente strutturato per fornire assistenza (Reed, 2010). Le cure palliative sono di natura interdisciplinare e le competenze degli operatori sanitari coinvolti possono sovrapporsi. Pertanto, l’assistenza infermieristica palliativa richiede una solida base teorica affinché gli interventi infermieristici siano complementari a quelli di altri professionisti della salute (Dobrina, et al., 2014)
Obiettivo dell’assistenza infermieristica palliativa è il miglioramento della qualità di vita della persona. La letteratura propone tre modelli infermieristici di cure palliative:
- La teoria condivisa di Desbiens (Desbienset al., 2012)utilizzata come quadro di riferimento in cure palliative per valutare i programmi di formazione infermieristica.
- Il modello di cura unitaria di Reed (Reed, 2010): l’adozione di questo quadro teorico offre l’opportunità di acquisire una conoscenza e un significato personali più profondi intorno ai fenomeni che circondano le cure palliative.
- Il modello di transizione di Murray (Murray, 2007) per le cure palliative: il modello ha come obiettivo l’integrazione dell’assistenza infermieristica palliativa nel contesto di un modello di gestione delle condizioni croniche tipiche del grande anziano. Murray sottolinea che le cure palliative sono simili al modello di gestione delle condizioni croniche in quanto valorizzano il processo decisionale della persona, la comunicazione empatica, la continuità di cura con interventi multiprofessionali e la modulazione dell’intensità degli interventi in base alla situazione clinica e funzionale della persona e della capacità di auto-cura della persona e della famiglia. Secondo il modello di transizione, l’assistenza palliativa infermieristica dovrebbe concentrarsi sulle preferenze delle persone e delle famiglie in merito a risultati e processi.
I concetti chiave delle tre teorie di assistenza infermieristica palliativa includono caratteristiche che possono essere raggruppate in tre categorie principali: la persona, l’infermiere e la relazione infermiere-persona.
Persona
Unicità: tutti e tre i modelli indicano che ciascuna persona è unica nei suoi bisogni, speranze, valori e preferenze (Desbiens et al., 2012; Murray, 2007; Reed, 2010)
Sofferenza: è un’esperienza multidimensionale correlata a sintomi fisici, disagio psicologico, preoccupazioni esistenziali e preoccupazioni relazionali e sociali(Reed, 2010). Pertanto, i bisogni fisici, psicologici, sociali e spirituali dei singoli e delle famiglie devono essere considerati nel processo delle cure palliative.
Autonomia:le persone devono essere considerate i decisori chiave nel processo di cure palliative. I comportamenti di auto-cura vanno incoraggiati, a prescindere dallo stadio della malattia, fino a quando la disabilità o la perdita di autonomia richiedono che siano gli infermieri a fornire assistenza compensativa(Desbiens et al., 2012; Murray, 2007).
Infermiere
Presenza:essere presenti per e con la persona, come momento/occasione fatto di tempo, spazio e fisicità: una presenza che richiede, per essere “autentica”, il sincero desiderio dell’infermiere di essere presente e concentrato nel momento di cura con la persona (Reed, 2010).
Approccio non giudicante: per stabilire relazioni terapeutiche con la persona e la sua famiglia e per apprezzare meglio la loro unicità e valutare i loro bisogni (Desbiens et al., 2012; Reed, 2010).
Auto-riflessione: tutti i modelli e le teorie hanno discusso l’idea che gli infermieri che forniscono cure palliative devono auto-riflettersi per diventare consapevoli della propria spiritualità, dei propri valori, delle proprie paure ed esperienze riferite alla vita, alla morte e al morire. Inoltre, Desbiens et al (2012) affermano che l’auto-riflessione può aiutare gli infermieri a diventare più consapevoli del loro ruolo (Desbiens et al., 2012).
Relazione infermiere-persona
Relazione terapeutica: gli infermieri rivestono una posizione unica per tessere relazioni significative con la persona e la sua famiglia. Attraverso un dialogo aperto, la comunicazione empatica e la presenza, gli infermieri e le infermiere delle cure palliative possono aiutare la persona e le sua famiglia a parlare del fine vita e delle loro paure (Desbiens et al., 2012; Murray, 2007; Reed, 2010).
Condivisione: sia i pazienti sia gli infermieri portano una parte di se stessi nella relazione attraverso la condivisione di valori, paure e significati riguardo alla vita e alla morte. Gli infermieri di cure palliative devono essere consapevoli delle implicazioni di queste interazioni: tale consapevolezza può impedire all’infermiere di focalizzarsi su se stesso e riconoscere che il significato attribuito alla qualità della vita appartiene alla persona e alla sua famiglia, non al professionista della salute (Desbiens et al., 2012; Reed, 2010).
Speranza realistica:nella relazione terapeutica, gli infermieri hanno un ruolo importante nel riorientare le speranze della persona e della sua famiglia aiutandoli a spostare l’obiettivo dalla guarigione alla cura. Questo processo aiuta la persona e la sua famiglia a trovare l’opportunità per affrontare i problemi significativi per la loro qualità di vita (Reed, 2010).
I concetti chiave delle tre teorie sono congruenti con la filosofia delle cure palliative e sottolineano un approccio centrato sulla persona e sulla sua famiglia. Attraverso l’arte di essere presenti in modo autentico in una relazione terapeutica, gli infermieri di cure palliative hanno un ruolo speciale e specifico nel fornire qualità della vita e sostegno alle persone e alle loro famiglie.
Gli infermieri coinvolti in questa assistenza dovrebbero ricevere una formazione avanzata in modelli e teorie palliative e di fine vita per guidare la loro pratica quotidiana.
Quesito 5: Quali modelli di assistenza palliativa si correlano ad esiti migliori?
La revisione di Luckett (Luckett et al., 2014)ha identificato più modelli di cure palliative adottati nei diversi contesti di cura e assistenza e ha evidenziato le caratteristiche di questi modelli supportate da evidenze.
Modelli di cure palliative a domicilio
I modelli di cure palliative erogati al domicilio delle persone sono finalizzati a supportare l’assistenza dei caregiver e dei servizi di assistenza domiciliare attraverso la consulenza di specialisti in cure palliative. La revisione della Cochrane (Gomes et al., 2013)conferma l’evidenza del beneficio delle cure palliative domiciliari nell’aiutare le persone (età compresa tra 57 e 77 anni eccetto uno studio con persone con età media di 30 anni) a morire a casa e a ridurre il carico dei sintomi senza incidere sul dolore del caregiver. In particolare la meta-analisi di sette studi con 1222 pazienti, inclusi tre RCT di alta qualità ha dimostrato che i servizi di cure palliative a domicilio aumentano di più del doppio la probabilità di morire a casa per le persone con malattie come il cancro, lo scompenso e la bronco-pneumopatia cronica ostruttiva. Inoltre, la sintesi narrativa ha mostrato evidenza di effetti positivi, piccoli ma statisticamente significativi, sul carico di sintomi che le persone provano a causa della malattia avanzata. La revisione ha anche mostrato che vi sono aree di maggiore incertezza in cui vi sono prove contraddittorie o inconcludenti (ad esempio controllo del dolore, soddisfazione della cura ed economicità).
Le caratteristiche più importanti dei modelli di assistenza domiciliare sono la comunicazione, il coordinamento, la pianificazione anticipata delle cure e il potenziamento delle competenze del team di cure palliative di base (compresi i medici di medicina generale) e dei caregiver informali (Luckett et al., 2014).
Modelli di cure palliative nelle strutture residenziali
Le strutture residenziali per anziani rappresentano un ambito particolarmente impegnativo per il miglioramento della qualità delle cure di fine vita. Gli anziani istituzionalizzati hanno meno probabilità di essere indirizzati a servizi specialistici di cure palliative per la consulenza o il case management, e hanno maggiori probabilità di avere un insufficiente controllo dei sintomi, più ospedalizzazioni non necessarie, pianificazione inadeguata dell’assistenza e più famiglie insoddisfatte dell’assistenza ricevuta dal loro caro nel fine vita. La revisione della Cochrane (Hall et al., 2008)pur sottolineando la mancanza, in letteratura, di una comprensione condivisa di ciò che dovrebbe essere un intervento di cure palliative per gli anziani istituzionalizzati, ha individuato risultati potenzialmente promettenti per tre interventi: valutazione dell’idoneità dei residenti per le cure palliative specialistiche, sviluppo di competenze palliative nelle strutture residenziali e trasferimento dei residenti con demenza allo stadio finale in unità speciali all’interno della stessa struttura. Tuttavia, senza la disponibilità di ulteriori valutazioni in merito all’efficacia, la Cochrane non raccomanda l’uso di questi interventi nella pratica clinica. Alcune caratteristiche degli interventi valutati nella revisione sono interessanti: ad esempio, la collaborazione tra le strutture residenziali e i servizi di cure palliative specialistiche che possono fornire consulenza per i residenti con esigenze complesse. I servizi specialistici possono anche fornire formazione e consulenza al personale per un approccio palliativo generale rivolto a tutti i residenti con bisogni palliativi, indipendentemente dalla loro diagnosi o prognosi. Tuttavia, la formazione è una condizione necessaria ma non sufficiente per migliorare la cura dei residenti. Anche altre componenti, come lo sviluppo di team multidisciplinari, sono probabilmente importanti anche se non sono disponibili studi che hanno valutato gli esiti.
Modelli di cure palliative nei setting per acuti
I modelli di cure palliative adottati in ospedale consistono in gran parte in servizi di consulenza specialistica, unità palliative o assistenza erogata da infermieri con competenze palliative avanzate.
I servizi di consulenza specialistica tendono a concentrarsi sulla discussione della prognosi e degli obiettivi di cura, in accordo con le preferenze della persona, la gestione dei sintomi, la pianificazione delle dimissioni e del supporto alla persona e alla sua famiglia.
I servizi di consulenza forniti dai team di cure palliative ospedaliere hanno dimostrato di migliorare il controllo dei sintomi e la qualità della vita, di alleviare il carico emotivo e migliorare la soddisfazione della persona e del suo caregiver (Higginson et al., 2003). Inoltre hanno comportato un risparmio sui costi ospedalieri (Morrison et al., 2010).
Il ricorso ai servizi di emergenza deriva da un controllo inadeguato dei sintomi e/o dall’assenza di adeguati servizi e professionisti nelle cure primarie. Un problema particolare è l’incertezza che i professionisti del pronto soccorso si trovano ad affrontare quando sono costretti a prendere decisioni in assenza di una case history dettagliata. Gli studi hanno identificato la capacità dei modelli coordinati di assistenza di ridurre il ricorso ai servizi di emergenza e i ricoveri impropri, in particolare nei reparti intensivi (Forero et al., 2012).
Modelli di assistenza palliativa nella transizione tra setting di cura
I modelli di assistenza palliativa devono affrontare le transizioni tra le diverse strutture di cura e assistenza (domicilio, struttura residenziale, ospedale) e/o quando la situazione richiede una risposta rapida a seguito di un repentino cambiamento dello stato clinico o per favorire il rispetto delle preferenze della persona per il luogo di cura (ad es. desiderio di tornare a casa quando è ancora possibile).
Poiché la persona e la sua famiglia possono non essere a conoscenza di quali servizi sono disponibili e di come accedervi (Burns et al., 2004), la transizione tra servizi diversi richiede uno sforzo e un coordinamento intensi per mettere in atto piani di gestione e assistenza per i caregiver.
L’importanza del supporto nelle transizioni è particolarmente importante nella demenza avanzata: a seguito di un ricovero per un evento acuto intercorrente (es. polmonite) laddove non sia disponibile un piano di assistenza condiviso, medici e infermieri possono non considerare l’approccio palliativo e avviare trattamenti inappropriati per prolungare la vita con effetti negativi sulla qualità della vita (Murphy et al., 2016).
Luckett (Luckett et al., 2014)ha identificato una serie di elementi dinamici che sono stati integrati nei modelli di cure palliative a domicilio, nelle strutture residenziali e in ospedale per consentire l’accesso a servizi appropriati, migliorare la comunicazione e il coordinamento tra servizi, migliorare la capacità di cura palliativa dei professionisti non esperti e dei caregiver, aumentare la capacità di rispondere rapidamente al modificarsi delle condizioni cliniche, dei bisogni e delle preferenze dei singoli:
Case Management: è una caratteristica ricorrente di molti modelli di successo. Il case management è un processo collaborativo che richiede il coordinamento tra più servizi (sanitari, sociali, religiosi) e prevede la pianificazione di un percorso assistenziale costruito sui bisogni della persona e della sua famiglia. Il case management assicura continuità di cura e assistenza nel tempo ed è associato a migliori esiti clinici, riduzione dell’istituzionalizzazione e dei ricoveri in ospedale. Il case management è più efficace quando è ad alta intensità, include una comunicazione efficace tra i servizi e quando sono presenti gli specialisti nella cura di casi complessi (Threapleton et al., 2017).
Assistenza condivisa: rappresenta un’opportunità per le persone di ricevere i benefici dell’intervento specialistico combinato con la continuità delle cure e la gestione della comorbilità fornita dai medici di medicina generale e da infermieri non specializzati in cure palliative, che mantengono la responsabilità di tutti gli aspetti dell’assistenza.Il modello si basa su uncoordinamento eccellente e reti consolidate. La revisione della Cochrane (Smith et al., 2017)nonfornisce prove a sostegno dell’introduzione dell’assistenza condivisa per il trattamento di pazienti con patologie croniche.
Assistenza Specialistica:a livello internazionale, i servizi di assistenza specialistica sono stati ampiamente adottati per migliorare i risultati dell’assistenza per le popolazioni rurali.
Una revisione Cochrane ha esaminato l’efficacia dei servizi di assistenza specialistica nell’ambito delle cure primarie e ospedaliere rurali implementati come uno degli elementi di interventi complessi e sfaccettati che coinvolgono la collaborazione dell’assistenza primaria. Gli autori concludono che i servizi di assistenza specialistica possono migliorare gli esiti, garantire l’erogazione di cure più efficaci e basate su evidenze e ridurre l’uso dei servizi ospedalieri. I costi aggiuntivi associati all’assistenza specialistica sembrano essere bilanciati da esiti migliori. Tuttavia nessuno degli studi inclusi nella revisione ha confrontato servizi di assistenza specialistica per le cure palliative (Luckett et al., 2014).
Le migliori cure palliative dovrebbero essere accessibili a tutti coloro che ne hanno bisogno, adattate alle esigenze della persona e della sua famiglia in modo tempestivo, superando i confini organizzativi e disciplinari attraverso strategie che supportano la comunicazione e il coordinamento.
Per le persone e per le loro famiglie va sottolineata la necessità di pianificare precocemente obiettivi di benessere (comfort care), che tengano conto del rispetto della dignità sul piano fisico, emotivo e spirituale e di riorientare gli interventi assistenziali per la gestione dei diversi problemi (per es. lesioni da pressione) verso la qualità della vita.
I modelli di assistenza palliativa dovrebbero includere elementi che supportano il case management tramite l’integrazione degli interventi specialistici di cure palliative con i servizi di assistenza primaria e di comunità e consentono le transizioni tra i vari luoghi di cura, comprese le strutture residenziali.
| RACCOMANDAZIONE 5a: In tutti i contesti di cura pianificare l’assistenza infermieristica palliativa considerando i bisogni e le preferenze della persona e della sua famiglia, privilegiando interventi orientati al comfort. |
| RACCOMANDAZIONE 5b: Aumentare le competenze dei team di cure palliative per migliorare l’individuazione dei sintomi, il loro controllo e la qualità della vita. |
| RACCOMANDAZIONE 5c: Garantire la continuità delle cure nelle transizioni tra servizi, strutture e luoghi di cura. |
| RACCOMANDAZIONE 5d: Garantire una risposta tempestiva a seguito di un repentino cambiamento dello stato clinico. |
L’alimentazione e l’idratazione
Giovanni Zaninetta, Federico Nicoli, Ermellina Zanetti
Razionale
Nel contesto delle cure palliative si possono presentare diverse problematiche cliniche ed etiche legate alla nutrizione e all’idratazione: avvicinandosi alla fine della vita è fisiologico che progressivamente la persona assuma una quantità ridotta di nutrienti o non sia più in grado di alimentarsi ed idratarsi per via orale.
Questa condizione è determinata dalla sindrome anoressia-cachessia, un quadro clinico complesso, caratterizzato dal progressivo deteriorarsi dei tessuti corporei (sia massa magra che massa grassa), indipendentemente dal costante o minore apporto nutrizionale. Tale termine è stato usato in passato per indicare la fase terminale delle patologie neoplastiche mentre attualmente viene utilizzato per tutte le patologie croniche in fase avanzata. L’anoressia di per sé contribuisce allo sviluppo della cachessia, ma non ne costituisce la causa principale che sembra invece attribuibile all’azione di citochine rilasciate dal sistema immunitario in risposta alla patologia di base (Venturiero et al., 2000).
Quando l’assunzione orale di cibo e liquidi non è più possibile o non fornisce i nutrienti in modo adeguatopuò essere necessario ricorrere alla integrazione con Supplementi Nutrizionali per Os (NOS) o alla nutrizione artificiale.La nutrizione e l’idratazione artificiali o medicalmente assistite sono una possibile soluzione che richiede, come tutti gli atti medici, l’adozione di regole specifiche. La nutrizione artificiale include la nutrizione enterale eparenterale. La somministrazione enterale di nutrienti comprende l’utilizzo di sonde nasogastriche o nasogastrodigiunali (SNG), la gastrostomia percutanea endoscopica (PEG) o la digiunostomia (PEGJ). La somministrazione parenterale include l’accesso endovenoso periferico o l’accesso venoso centrale. L’idratazione artificiale consiste nella somministrazione di soluzioni idriche o elettrolitiche attraverso infusione per via endovenosa (periferica o centrale) o sottocutanea (dermoclisi) o attraverso SNG, PEG o PEGJ.
La decisione di somministrare liquidi e alimenti per via enterale o parenterale richiede da parte dei clinici un’attenta valutazione dei rischi e dei benefici attesi oltre che delle eventuali disposizioni anticipate di trattamento espresse dalla persona: ai sensi della Legge 22 dicembre 2017, n. 219 “Norme in materia di consenso informato e di disposizioni anticipate di trattamento” la nutrizione e l’idratazione artificiale sono infatti considerate trattamenti sanitari, per i quali è necessario il consenso della persona.
Un possibile prolungamento della vita deve sempre essere messo in relazione con il benessere della persona tenendo ben presente che questo prolungamento non può mai essere confuso con il posticipare indebitamente l’evento morte. Sospendere o non iniziare un trattamento che non fornisce alcun vantaggio o che è diventato sproporzionato è corretto sia da un punto di vista etico che legale (Druml et al., 2016).
La decisione di non iniziare o sospendere alimentazione e idratazione medicalmente assistite deve tenere conto delle prospettive etiche, emotive e culturali della persona, dei famigliari e degli operatori: la riduzione dell’assunzione orale di nutrienti e acqua nel contesto della sindrome da anoressia-cachessia che si verifica nelle ultime fasi della malattia terminale è infatti una fonte importante di ansia per pazienti, famiglie e personale sanitario. A giudizio dei familiari la proposta di sospendere l’alimentazione riflette la sottovalutazione, da parte di medici e infermieri, del disagio associato all’anoressia e aumenta in loro la convinzione che i loro cari non ricevano cure ottimali. Per evitare tale difficoltà è necessario quanto prima coinvolgere nel processo decisionale le famiglie, con le loro apprensioni e aspettative, per migliorare il clima attorno alla persona in fase terminale, producendo anche un effetto positivo sull’elaborazione del lutto.
È necessario anticipare la comunicazione della possibile anoressia e parlarne con il malato e i suoi familiari prima che il sintomo si manifesti, illustrando i limitati benefici e i possibili effetti collaterali della nutrizione enterale o parenterale, informandoli in merito agli interventi che saranno attuati per alleviare i sintomi disturbanti, quali la sete e la secchezza delle mucose. È altresì necessario coinvolgere nel processo decisionale e comunicativo tutti i membri dell’equipe per ridurne l’ansia e il disagio (Del Rio et al., 2012).
Conoscere i benefici percepiti rispetto all’idratazione artificiale da parte della persona e dei suoi cargiver è fondamentale per discutere con loro di benefici e rischi e coinvolgerli nelle decisioni.
Nel caso in cui la persona e i suoi familiari manifestassero opinioni contrastanti sulla nutrizione o sull’idratazione è necessario accompagnare rispettosamente entrambe le parti, promuovere un dialogo empatico, chiarire i falsi miti e aiutare i familiari a comprendere realisticamente i bisogni e la volontà della persona.
Quesito 6: Quali sono i criteri per iniziare, non iniziare o sospendere la nutrizione artificiale?
L’OMS nel 1998 affermava che “La nutrizione intravenosa è controindicata nei pazienti terminali. Non migliora l’aumento ponderale e non prolunga la vita. La nutrizione enterale ha un ruolo molto limitato nella malattia terminale. Dovrebbe essere usata solo nei pazienti che ne hanno un chiaro beneficio. La nutrizione artificiale non dovrebbe essere usata nei pazienti moribondi” (World Health Organization, 1998). Più recentemente la revisione della Cochrane (Good et al., 2014) afferma che, in assenza di studi di buona qualità per formulare raccomandazioni relative all’uso della nutrizione medicalmente assistita nei pazienti in cure palliative, i medici dovranno assumere una decisione in base ai benefici attesi e alle possibili complicanze nelle singole situazioni.
Gli obiettivi della nutrizione artificiale, parenterale o enterale, devono essere calibrati sulle reali esigenze della persona, evitando di inseguire ipotetici fabbisogni calorici o di assecondare le richieste dei familiari. Le decisioni assunte possono richiedere una modifica o un riadattamento al variare del quadro clinico (Kelly, 2006).
La nutrizione artificiale va prescritta, e quindi iniziata, quando vi è la ragionevole ipotesi clinica che la sopravvivenza prevista per l’evoluzione naturale della malattia sia ridotta dalla concomitante malnutrizione, secondaria all’impossibilità di assumere alimenti. Come per tutte le terapie, anche per la nutrizione artificiale è necessario valutare il rapporto rischio/beneficio (SINPE, 2002).
Tale rapporto si è dimostrato sfavorevole nella persona con demenza in fase avanzata: il ricorso all’alimentazione tramite PEG non migliora la sopravvivenza (Teno et al., 2012)ed è associato ad un alto rischio di complicanze, inclusa l’aumentata mortalità perioperatoria per la gastrostomia (Finucane et al., 1999; Sampson et al., 2009). L’unica indicazione all’alimentazione enterale nelle persone con demenza severa è la presenza di una condizione, che limita l’alimentazione per os, potenzialmente reversibile (NICE, 2018).
| RACCOMANDAZIONE 6a: Adottare una procedura decisionale che coinvolga la persona, i suoi familiari e gli operatori sanitari per iniziare/non iniziare/sospendere la nutrizione artificiale; quando la persona non fosse in grado di comunicare considerare le Disposizioni Anticipate di Trattamento, se disponibili. La procedura dovrà considerare la condizione clinica, i benefici attesi, i possibili danni, la qualità della vita, il benessere psicologico, relazionale, spirituale e sociale della persona.
Sospendere la nutrizione artificiale quando non si manifesta il beneficio atteso. |
| RACCOMANDAZIONE 6b: Iniziare la nutrizione artificiale solo quando vi sia la ragionevole ipotesi clinica che la sopravvivenza prevista per l’evoluzione naturale della malattia sia ridotta dalla concomitante malnutrizione, secondaria all’impossibilità di assumere alimenti per via orale. |
| RACCOMANDAZIONE 6c: Nella persona con demenza in fase avanzata non ricorrere all’alimentazione tramite gastrostomia o digiunostomia percutanea. Tale procedura non migliora la sopravvivenza ed è associata ad un alto rischio di complicanze, a meno che non sia indicata per una condizione, che limita l’alimentazione per os, potenzialmente reversibile. |
Quesito 7: Quali sono i criteri per iniziare, non iniziare o sospendere l’idratazione artificiale?
Non ci sono indicazioni chiare per l’idratazione artificiale nelle fasi terminali e la maggior parte degli studi include pazienti con un cancro allo stadio terminale e non è noto se i risultati possano essere estrapolati per altre condizioni cliniche e nei soggetti molto anziani.
La scarsa idratazione conduce a un circolo vizioso di deficit di liquidi, accumulo di farmaci e il peggioramento o l’emergere di sintomi quali affaticamento, vertigini e riduzione della coscienza. La funzionalità renale può essere compromessa, con un aumentato rischio di un progressivo accumulo di farmaci, in particolare degli oppiacei, ed un aumento degli effetti indesiderati. Clinicamente, la disidratazione e l’ipovolemia si manifestano con sete, nausea, delirium, affaticamento, irritabilità, ma alcuni studi hanno suggerito che questi sintomi sono presenti indipendentemente dallo stato di idratazione (Bear et al., 2017).
I segni clinici della disidratazione non dovrebbero da soli determinare la decisione terapeutica; in particolare, in caso di comorbidità è necessaria cautela nella valutazione e nell’interpretazione. Piuttosto è necessario riflettere sulle ripercussioni dell’idratazione e valutare in particolare in che misura essa possa contribuire ad alleviare i sintomi e a migliorare la qualità di vita.
Tra gli studi inclusi nella revisione della Cochrane (Good et al. 2014), tutti riferiti a pazienti oncologici in fase terminale, un solo studio ha rilevato che la sedazione e il mioclono (contrazioni muscolari involontarie) sono migliorati nel gruppo di intervento che riceveva 1000 cc di liquidi in vena o sottocute/die. Un altro studio ha dimostrato che la disidratazione era significativamente più alta nel gruppo di controllo, ma che alcuni sintomi di ritenzione di liquidi (versamento pleurico, edema periferico e ascite) erano significativamente più alti nel gruppo che riceveva l’idratazione (da 838 cca 1405 ml/die tramine la via venosa durante le ultime 3 settimane di vita). L’unico studio che ha considerato la sopravvivenza come risultato non ha trovato differenze tra i due gruppi. Gli autori concludono affermando che gli studi pubblicati non mostrano alcun beneficio significativo nell’uso dell’idratazione medicalmente assistita nei pazienti in cure palliative; tuttavia, la qualità degli studi è insufficiente per fornire raccomandazioni definitive.
Nel caso di soggetti con insufficienza cardiaca, stasi polmonare, edemi, ascite, sintomi da aumento della pressione endocranica si auspica una dovuta prudenza nella somministrazione di liquidi: in particolare la somministrazione parenterale intravenosa può provocare rapidamente un sovraccarico di volume.La somministrazione sottocutanea, per contro, non comporta alcun pericolo in tal senso, sebbene le evidenze sull’efficacia della somministrazione di fluidi per via sottocutanea mediante ipodermoclisi provengano da studi randomizzati controllati relativamente piccoli o da studi osservazionali(Good et al. 2014). Coerentemente con i risultati della revisione della Cochrane (Ker et al. 2015), anche la revisione di Caccialanza (Caccialanza et al 2018) evidenzia che l’infusione sottocutanea può fornire un mezzo alternativo di somministrazione di liquidi quando l’accesso venoso periferico o centrale è difficile o impossibile. Inoltre, l’infusione sottocutanea ha diversi vantaggi rispetto all’infusione endovenosa, inclusa la facilità di applicazione in molteplici contesti (compreso il domicilio),il basso costo e la mancanza di potenziali complicanze gravi, in particolare le infezioni.Tuttavia la revisione sistematica di Forbat (Forbat et al. 2017) sottolinea che sono pochi gli studi di buona qualità condotti sulla popolazione anziana con malattie croniche e, in particolare, mancano indicazioni, basate su evidenze, relative alla tecnica di infusione mediante ipodermoclisi:sono necessari ulteriori studi che forniscano, sulla base di prove empiriche, indicazioni su modalità, sede, volume e velocità dell’infusione.
L’obiettivo dell’idratazione artificiale è il raggiungimento di una corretta idratazione, non inferiore (con rischio di disidratazione) e non superiore (con rischio di edema polmonare, edemi degli arti, ecc.) alle reali esigenze della persona. Nakajima e colleghi (Nakajima et al., 2014) hanno valutato nei soggetti in fase terminale (ultime 4 settimane) se la somministrazione parenterale di liquidi (1000cc/die) riduceva la sensazione di sete, la spossatezza e la comparsa di delirium: rispetto alla sensazione di sete si sono dimostrati più efficaci nell’alleviare i sintomi gli interventi assistenziali; la spossatezza si è ridotta nei soggetti che avevano una prognosi di più mesi, uno stato funzionale meglio conservato, occlusione intestinale; nessun effetto è stato dimostrato rispetto alla comparsa di delirium.
Fritzson (Fritzson et al., 2015) ha condotto uno studio di coorte storica su 530 pazienti che sono deceduti in ospedale nella contea di Västerbotten (Svezia) tra il Gennaio 2011 e il 30 giugno 2012. Sono stati identificati mediante randomizzazione stratificata 140 casi che avevano ricevuto idratazione parenterale e 140 controlli che non avevano ricevuto idratazione per via parenterale, abbinati per età, sesso e malattia principale. L’età media in entrambi i gruppi era di 80 anni. I gruppi sono stati confrontati per la presenza documentata di dispnea, secrezioni respiratorie, ansia, nausea e confusione durante le ultime 24 ore e l’ultima settimana di vita. Il confronto tra il gruppo che riceveva idratazione e il gruppo che non riceveva idratazione ha mostrato una prevalenza statisticamente significativa di dispnea nei soggetti che ricevevano idratazione: 51% vs 22% nelle ultime 24 ore (p <0,0001) e 70% vs 45% nell’ultima settimana di vita (p = 0,0005). Nei soggetti che ricevevano idratazione parenterale è stata osservata una prevalenza statisticamente significativa di confusione e secrezioni respiratorie; non sono state trovate differenze riguardo all’ansia o alla nausea.
L’efficacia dell’idratazione deve essere rivalutata quotidianamente, soppesandone benefici ed eventuali svantaggi: l’idratazione parenterale, infatti, può alleviare il disagio associato alla disidratazione delle mucose e alla secchezza del cavo orale, ma può peggiorare gli edemi periferici, l’ascite, il versamento pleurico e aumentare le secrezioni bronchiali (Nakajima et al., 2014;Morita et al., 2005). Se la somministrazione di liquidi richiede l’inserzione di un catetere venoso centrale, va valutato il rischio associato al suo inserimento e il rischio di infezione. Nelle persone con prognosi breve l’idratazione non apporta vantaggi, anzi potrebbe essere causa di complicanze del quadro clinico (Morita et al., 2005).
Uno studio longitudinale ha dimostrato che per i pazienti morenti non c’era alcun segno di sofferenza attribuibile al calo dell’assunzione orale di nutrienti e liquidi: si è osservato che associando alla riduzione graduale dell’assunzione di nutrienti e liquidi la fornitura di una buona igiene orale, i pazienti non soffrivano degli effetti negativi della disidratazione terminale (Van der Riet, 2006).
Le determinanti della qualità della vita e della morte variano tra gli individui e la soggettività è essenziale per definire ciò che è importante per ogni persona. I clinici devono assumere una decisione in base ai benefici attesi e ai possibili danni dell’idratazione artificiale nelle singole circostanze. Sono necessarie ulteriori ricerche per determinare quali sottogruppi possono trarre beneficio dalla somministazione parenterale di liquidi (Morita et al., 2005).
Alla decisione di non iniziare o di sospendere l’idratazione è opportuno associare la comunicazione alla persona e alla sua famiglia relativamente agli interventi che verranno implementati per ridurre il disagio associato ai sintomi disturbanti quali la sete e la secchezza delle fauci. Tra gli interventi riportati in letteratura la cura dell’igiene orale è stata oggetto di più studi (Kvalheim et al., 2016; Croyère et al., 2011; Milligan et al., 2001). Sebbene siano note le complicanze associate ad una carente attenzione all’igiene orale (disagio, dolore, mucosite, mal di testa, cattivo odore, modifiche nelle abitudini alimentari e riduzione delle relazioni sociali, rischio di polmonite negli anziani disfagici) gli studi non sono concordi sugli interventi e sulle procedure per garantire un’efficace igiene orale e non sono disponibili studi di efficacia sui metodi e sui prodotti utilizzati per l’igiene orale (Kvalheim et al. 2016).
L’associazione canadese dei medici dentisti suggerisce alcuni interventi palliativi per ridurre il discomfort provocato dalla xerostomia nelle persone anziane: inumidire periodicamente il cavo orale con tamponi precedentemente immersi in soluzione fisiologica o collutorio (senza alcool). Non utilizzare tamponi imbibiti di limone e glicerina: aumentano la secchezza del cavo orale. Utilizzare più volte al giorno un balsamo a base di lanolina per le labbra. Il ghiaccio in piccoli pezzi può essere utilizzato nelle persone non disfagiche (Stein & Aalboe, 2015).
| RACCOMANDAZIONE 7a: Adottare una procedura decisionale che coinvolga la persona, i suoi familiari e gli operatori sanitariper iniziare/non iniziare/sospendere l’idratazione artificiale; quando la persona non fosse in grado di comunicare considerare le Disposizioni Anticipate di Trattamento, qualora disponibili. La procedura dovrà considerare la condizione clinica, i benefici attesi, i possibili danni, la qualità della vita e il benessere psicologico e spirituale della persona.
Sospendere l’idratazione artificiale quando non si manifesta il beneficio atteso. |
| RACCOMANDAZIONE 7b: Associare alla decisione di non iniziare o di sospendere l’idratazione la comunicazione alla persona e alla sua famiglia relativamente agli interventi che saranno implementati per ridurre il disagio associato ai sintomi disturbanti quali la sete e la secchezza delle fauci. |
La valutazione del dolore nella persona non comunicante
Deborah Chiesa, Ermellina Zanetti
Razionale
Il dolore è un sintomo comune nei pazienti anziani: fino ad 1/3 della popolazione sopra i 60 anni presenta dolore cronico, il 50% delle persone over 80 assume regolarmente analgesici ed è segnalata una prevalenza del dolore in circa il 60% dei residenti delle strutture per anziani. Le evidenze suggeriscono che a tutt’oggi vi sia una sottostima del dolore e quindi uno scarso trattamento dello stesso (Rottenberg et al., 2015).
Le indicazioni generali per la valutazione del dolore cronico negli anziani fanno riferimento a quelle elaborate dall’American Geriatric Society-AGS (AGS Panel on Chronic Pain in Older Persons, 1998) che raccomanda di considerare:
- anamnesi, esame obiettivo, esami laboratorio e altri test diagnostici;
- intensità, caratterizzazione, frequenza, localizzazione, durata, fattori precipitanti e allevianti;
- storia dei farmaci analgesici e terapie in corso, eventuali eventi avversi precedenti;
- valutazione delle disabilità (sia funzionali che motorie) associate al dolore e della funzione psicosociale (eventuale presenza di sindrome depressiva);
- valutazione del dolore tramite strumenti standard (es. VAS, NRS);
- per i soggetti con deficit cognitivo o difficoltà nella comunicazione utilizzo di scale adattate ai loro bisogni e che tengano conto delle difficoltà. Fondamentale il caregiver per “interpretare” i comportamenti della persona che possono essere riconducibili alla presenza di dolore;
- valutazione periodica del dolore e del suo trattamento (utilizzando lo stesso strumento utilizzato per la valutazione iniziale).
La valutazione del dolore da parte della persona è la misura più accurata e affidabile dell’intensità del dolore, e questo vale per i pazienti di tutte le età: la Numeric Rating Scale (NRS), la Visual Analogue Scale (VAS), la Face Pain Scale (FPS), e la Verbal Descriptor Scale (VDS) sono valide e accettabili per l’uso negli anziani e possono essere utilizzate in soggetti con compromissione cognitiva da lieve a moderata (Herr, 2002; Herr & Garand, 2001; Herr et al., 1998; Wynne et al., 2000).
La valutazione del dolore secondo il panel AGS (AGS Panel on Chronic Pain in Older Persons, 1998) è complicata quando riferita a persone con demenza o, più in generale, con difficoltà nella comunicazione, poichè i disturbi comportamentali e i deficit cognitivi e/o di linguaggio possono rappresentare fattori confondenti, oltre che rendere difficile alla persona riferire a familiari e curanti la presenza e l’intensità del dolore.
Nelle persone affette da demenza è maggiore il rischio di insufficiente ed inadeguato trattamento del dolore per scarsa rilevazione dello stesso: il decadimento cognitivo rende la persona incapace di riconoscere il dolore, di ricordarlo, di quantificarlo, di comunicarne spontaneamente la presenza, che spesso viene invece denunciata da altri segnali come cambiamenti del comportamento, alterazioni neurovegetative, disturbi del sonno e dell’appetito, disturbi motori, vocalizzazioni (Van Dalen-Kok et al., 2015).
Quesito 8: Per valutare la presenza di dolore in una persona non in grado di comunicare è efficace l’adozione di uno strumento oggettivo di valutazione del dolore?
La maggior parte degli strumenti di valutazione del dolore oggettivi [per la descrizione delle caratteristiche dei principali strumenti oggettivi di valutazione del dolore si rimanda all’articolo di Storti (Storti et al., 2014)] proposti dalla letteratura si basano sull’assunzione e sulle raccomandazioni del gruppo dell’American Geriatrics Society (AGS) che ha individuato sei aree da osservare per valutare, indirettamente, la presenza di dolore:
- espressione del viso,
- vocalizzazione negativa,
- movimenti del corpo,
- cambiamenti delle relazioni interpersonali,
- cambiamenti nelle attività di base,
- cambiamenti dello stato mentale.
Tuttavia nelle persone affette da demenza in fase avanzata, che tra le persone non in grado di comunicare sono una quota rilevante, può essere difficile riferire alla presenza del dolore manifestazioni che caratterizzano la risposta comportamentale della persona ad una gamma molto ampia di stimoli.
Inoltre la maggior parte degli strumenti è validata per accertare la presenza di dolore, ma non l’intensità del dolore: Husebo et al nella loro revisione sistematica della letteratura (Husebo et al., 2016) affermano che non è noto se la presenza di un numero maggiore di comportamenti riferiti alla presenza di dolore significhi anche più dolore. Inoltre i comportamenti che possono essere valutati hanno lo stesso peso: nessuno studio ha cercato di differenziare l’intensità del dolore e pertanto non è possibile riconoscere alcuni comportamenti (es. l’urlo o l’agitazione) come un’indicazione di maggior dolore.
L’osservazione del comportamento può indicare la presenza di dolore in un individuo ma non fornisce informazioni sull’eziologia del dolore. Pertanto, la valutazione del dolore non dovrebbe dipendere esclusivamente dall’osservazione del comportamento condotta utilizzando strumenti standardizzati, ma bensì essere considerata una componente di un approccio multidimensionale alla valutazione del dolore. L’utilizzo di uno strumento di valutazione osservazionale non è controidicato anche se nessuna delle revisioni e meta-analisi ne indica uno in particolare.
La meta-analisi condottta da Lichtner nel 2014 (Lichtner et al., 2014) presenta una sintesi delle review sistematiche sulle proprietà psicometriche e l’utilità clinica di 28 strumenti di valutazione del dolore nei pazienti affetti da demenza. Gli autori concludono affermando che vi sono prove limitate sulla loro affidabilità, validità e utilità clinica. In generale è emerso che non vi è uno strumento migliore degli altri e che non è consigliabile elaborare nuovi strumenti se si utilizzano le stesse basi concettuali, poichè ve ne sono già molti disponibili. Inoltre le ricerche sull’utilità clinica degli strumenti dovrebbero includere la valutazione del loro impatto in termini di scelta del trattamento e sull’outcome. Anche Husebo (Husebo et al., 2016) conclude la sua revisione affermando che non vi è accordo su quale strumento di valutazione debba essere utilizzato e sottolinea la necessità di disporre di strumenti sia per identificare la presenza di dolore, sia per valutare l’efficacia della terapia.
Tuttavia gli autori forniscono alcune indicazioni:
- La valutazione del comportamento deve essere affidata ad una persona che conosce l’assistito. Questa indicazione (di difficile attuazione in ambiente ospedaliero) è fondata sull’evidenza che il gold standard è la valutazione del dolore da parte della persona. Quando questo non è possibile, si suggerisce un cosiddetto “silver standard”, cioè fare riferimento al caregiver che si occupa dell’assistenza e della sorveglianza quotidianamente. Esiste infatti un consenso generale sul fatto che la valutazione del dolore nelle persone non comunicanti dovrebbe essere basata sull’osservazione del comportamento della persona durante le attività della vita quotidiana: il caregiver o l’operatore sanitario che conosce l’assistito è il più adatto a cogliere i cambiamenti nel comportamento (Husebo et al., 2016; Lichtner et al., 2014).
- La scelta di uno strumento osservazionale deve considerare la sua applicabilità nella pratica quotidiana e l’utilità clinica. L’applicabilità include la facilità d’uso e il tempo richiesto per la compilazione. Gli strumenti più facili da utilizzare secondo la revisione di Lichtner (Lichtner et al., 2014) sono il CNA Pain Assessment tool (CPAT) (Cervo et al., 2007, 2009)e l’ Abbey Pain Scale (Abbey et al., 2004) di cui è disponibile la versione italiana (Storti, 2009) e il Non-Communicative Patients’ Pain Assessment Instrument – NOPPAIN (McGuire et al., 2016) di cui è disponibile la versione italiana validata in ambito ospedaliero e per la formazione (Ferrari et al., 2009; Novello et al., 2009). Un limite del NOPPAIN, colmabile con ulteriori studi, è la mancanza di criteri specifici per l’interpretazione del punteggio totale. Va ricordato che la scala è indicata prevalentemente per una valutazione iniziale del dolore e non esime dalla necessità di effettuare una valutazione multidisciplinare e multidimensionale (Novello et al., 2009). La Pain Assessment in Advanced Dementia (PAINAD) Scale (Warden et al., 2003), di cui è disponibile la versione italiana (Costardi et al., 2007) è definita dagli stessi autori semplice da utilizzare. Tuttavia, le dimensioni del campione utilizzate nello sviluppo di PAINAD erano piccole (N = 19), il che ne limita i risultati. Nonostante la buona qualità psicometrica preliminare, PAINAD deve essere ulteriormente testata (inclusa l’affidabilità test-retest) in un campione più ampio (Lichtner et al., 2014). Inoltre non è chiara l’interpretazione del punteggio: Zwakhalen sulla base dei risultati di più fonti di dati disponibili, consiglia di utilizzare un punteggio PAINAD di 2 o più come indicatore di probabile dolore. Un punteggio pari ad 1 richiede ulteriori valutazioni cliniche per confermare la possibile presenza di dolore (Zwakhalen et al., 2012).
L’utilità clinica è “l’utilità della misurazione per il processo decisionale”, ovvero per ulteriori azioni, come la somministrazione di analgesici: tra gli strumenti l’unico testato per valutare la risposta alla terapia nei pazienti con demenza è il Mobilization-Observation-Behaviour-Intensity-Dementia pain scale – MOBID-2 (Husebo et al., 2016). La presenza di un cut-off contribuisce al raggiungimento dell’utilità clinica, ad esempio per aiutare a discriminare la presenza e assenza di dolore, o per associare la scala con un algoritmo di trattamento. Il cut off è indicato per Doloplus-2 (The Doloplus web-site. Available from: http://www.doloplus.fr/index.php), di cui è disponibile la versione validata in lingua italiana (Pickering et al., 2010).
| RACCOMANDAZIONE 8a: Valutare la presenza di dolore nelle persone non comunicanti attraverso un approccio multidimensionale, osservando il comportamento durante le attività della vita quotidiana: modifiche del comportamento abituale (relazioni e attività) suggeriscono la presenza di dolore. Il caregiver o l’operatore sanitario che meglio conosce l’assistito è il più adatto a cogliere i cambiamenti del comportamento. |
| RACCOMANDAZIONE 8b: Adottare uno strumento osservazionale per valutare la presenza del dolore, scegliendo quello più applicabile nel contesto, considerandone l’utilità clinica. |
La terapia farmacologica e gli accertamenti diagnostici
Deborah Chiesa
Razionale
L’età avanzata è associata ad un’elevata prevalenza di patologie e ad un conseguente maggior utilizzo di farmaci. Il termine “polifarmacoterapia” può essere utilizzato in una duplice accezione: quantitativa e qualitativa. Da un punto di vista quantitativo polifarmacoterapia indica l’utilizzo di 5 o più farmaci per lo stesso paziente. Si tratta peraltro di una definizione troppo semplicistica: perchè se è vero che le reazioni avverse e le interazioni farmacologiche aumentano con l’aumentare del numero di farmaci assunti contemporaneamente, d’altra parte quando una terapia è stata ottimizzata sul paziente, ha delle basi di evidenza scientifica, è prescritta su specifiche indicazioni ed è attentamente monitorata nel tempo potrebbe essere comunque considerata adeguata. Più corretta può pertanto essere la definizione qualitativa di polifarmacoterapia come l’uso di molteplici farmaci non necessari, senza indicazione, inefficaci o dannosi.
La polifarmacoterapia è molto frequente nelle strutture residenziali per gli anziani. Nello studio SHELTER, condotto in 57 strutture residenziali di 7 paesi dell’Unione europea – Repubblica Ceca, Inghilterra, Finlandia, Francia, Germania, Italia e Paesi Bassie in Israele, per complessivi 4.156 residenti, è stata riscontrata polifarmacoterapia nel 74% dei residenti: nel 49.7 % erano prescritti da 5 a 9 farmaci e nel 24.3% un numero di farmaci uguale o superiore a 10 (Onder et al., 2012).
La polifarmacoterapia può avere molteplici effetti negativi sia sulla persona (rischio di effetti avversi, riduzione dell’aderenza alla terapia, interazioni farmaco-farmaco, riduzione dell’autonomia funzionale, aumento del rischio di sindromi geriatriche come le cadute, il decadimento cognitivo, la malnutrizione e l’incontinenza urinaria) sia, in termini economici, sulla società.
Nel corso degli ultimi anni l’attenzione al problema della polifarmacoterapia ha fatto sì che venissero definiti alcuni criteri per aiutare il clinico ad ottimizzare la terapia del singolo paziente definendo le indicazioni cliniche, gli adeguamenti posologici, i rischi e i benefici, identificando gli eventi avversi, valutando le interazioni farmaco-farmaco (Lavan et al., 2018; Disalvo et al., 2016; Panel-AGS, 2015;Gallagher e O’Mahony, 2008; Holmes et al., 2008).
Nella prescrizione di una terapia farmacologica bisogna tener conto delle indicazioni cliniche del farmaco, dei benefici attesi, dei potenziali eventi avversi e dell’effettiva possibilità di aderenza alla terapia. Ma è importante che la prescrizione di un farmaco non risponda solo all’indicazione clinica della terapia ma ad una valutazione più globale del paziente e dell’obiettivo generale che si si prefigge: il trattamento della/e patologia/e, il controllo dei sintomi o le cure palliative.
La valutazione multidimensionale geriatrica e gli indicatori dello stato di salute che sono stati validati negli anni possono aiutare a mettere in luce tutte le caratteristiche da considerare per valutare la terapia di ciascun paziente.
Quesito 9: Quali farmacie quali accertamenti diagnostici sono considerati potenzialmente inappropriati nei pazienti anziani con limitata aspettativa di vita?
Negli ultimi anni sono stati pubblicati alcuni criteri di appropiatezza farmacologica applicabili ai pazienti anziani: Beers Criteria (Panel-AGS, 2015), START and STOPP (Gallagher e O’Mahony, 2008) e, più recentemente, Holmes’ Criteria (Disalvo et al., 2016; Holmes et al., 2008) focalizzati sull’inappropiatezza prescrittiva nei pazienti affetti da demenza terminale e STOPPFrail (Lavan et al., 2018) per i pazienti “fragili” con limitata aspettativa di vita. In particolare questi ultimi criteri sono proposti come strumento di valutazione della terapia di persone anziane (>=65 anni) affette da una patologia in stadio terminale, con severo decadimento cognitivo e/o funzionale, con un’aspettativa di vita limitata (<= 1 anno) nelle quali l’obiettivo primario è il controllo dei sintomi piuttosto che la prevenzione della progressione della malattia. Ad un panel comprendente geriatri, specialisti di diverse discipline, medici di medicina generale e farmacisti clinici è stato sottoposto un elenco di 27 criteri, 2 dei quali di ordine generale (l’opportunità di sospendere farmaci privi di indicazione o per i quali la compliance sia bassa) e 25 riferiti ad altrettante classi di farmaci il cui utilizzo è da considerarsi non appropriato nei pazienti che rispondono alle caratteristiche sopra riportate. A fronte di un pieno consenso degli esperti su 25 criteri, solo per due classi di farmaci (anticoagulanti e antidepressivi) non sono stati raggiunti sufficienti livelli di consenso.
Così come la terapia farmacologica necessita di continue revisioni che seguano di pari passo l’evoluzione clinica del paziente, anche le decisioni in merito all’esecuzione di indagini diagnostiche vanno valutate attentamente. Molti autori (Mitchell et al., 2004 e 2009; Toscani et al., 2008) hanno segnalato l’elevata frequenza con cui pazienti con demenza avanzata ricoverati nelle nursing home sono sottoposti a procedure cliniche non necessarie e spesso causa di disagio quali l’ospedalizzazione, la rianimazione, l’alimentazione enterale ed interventi diagnostici
In letteratura non vi sono linee guida che indichino quali approfondimenti diagnostici siano raccomandati e in quali situazioni cliniche. Pertanto si ritiene che le indicazioni debbano essere valutate di caso in caso. Se il paziente si trova in una situazione di urgenza si ritiene che le indagini diagnostiche siano accettabili se possono chiarire il quadro clinico e diagnosticare eventuali condizioni che, se risolte, potrebbero migliorare la sintomatologia e la qualità di vita (es. un intervento per risolvere un quadro di occlusione intestinale). Diversa è invece la decisione di intraprendere un percorso diagnostico ab inizio per ricercare una eventuale patologia che potrebbe essere sopraggiunta, avendo come unico obiettivo una diagnosi senza che a questo segua una possibilità di trattamento (es. la ricerca di un’eventuale patologia neoplastica che non trova però seguito in un trattamento adeguato).
| RACCOMANDAZIONE 9a: Verificare sistematicamente, di pari passo con l’evoluzione clinica, gli obiettivi delle terapie: trattamento patologia/e, terapia sostitutiva, controllo sintomi. |
| RACCOMANDAZIONE 9b: Effettuare periodicamente la riconciliazione terapeutica per individuare, in relazione all’evoluzione clinica, i farmaci potenzialmente inappropriati e il rischio di non aderenza. |
Quesito 10: Quali farmaci utilizzare per il trattamento del dolore nel grande anziano?
Le revisioni sistematiche di Makris (Makris et al., 2014) e di Husebo (Husebo et al., 2016) raccomandano, per i pazienti anziani con dolore persistente, l’utilizzo di unapproccio a gradini utilizzando come prima scelta il paracetamolo e successivamente i farmaci oppiodi. Viene inoltre indicato come migliore l’utilizzo di due farmaci con effetti complementari piuttosto che un’alta dose di un solo farmaco. I FANS non sono raccomandati per l’utilizzo a lungo-termine. Si consiglia di considerare l’utilizzo dei farmaci SSRI o NSSRI nei pazienti in cui concomitano sindrome depressiva e dolore. Si sottolinea inoltre l’importanza di un approccio contemporaneo farmacologico e non-farmacologico come la terapia fisica, occupazionale ed il training cognitivo.
Punti chiave del trattamento (Makris et al., 2014):
- Valutare il trattamento a seconda degli obiettivi che ci si prefigge per la persona (es. incrementare / mantenere le abilità della vita quotidiana).
- Utilizzare combinazioni di famaci con differenti meccanismi d’azione per migliorare l’efficacia analgesica.
- Paracetamolo come farmaco di prima linea.
- Evitare l’utilizzo a lungo termine dei FANS.
- Oppiodi appropriati se i farmaci di prima linea non funzionano.
- Considerare antidepressivi (SSRI o NSSRI).
- Implementare il monitoraggio di efficacia, tollerabilità, aderenza di ogni nuovo farmaco.
- L’attività fisica è una componente fondamentale del trattamento del dolore persistente.
- Educare i pazienti sulla sicurezza e sull’efficacia delle terapie comportamentali.
- Determinare periodicamente se gli obiettivi sono stati raggiunti ed implementare -ridurre o sospendere la terapia ed eventualmente aggiungere terapia occupazionale e fisica.
Nella Talbella 2 sono riassunti, per ciascun farmaco indicato per il trattamento del dolore, le raccomandazioni e i possibili effetti collaterali.
| FARMACO | RACCOMANDAZIONE | EFFETTI COLLATERALI |
| Paracetamolo | Trattamento di prima linea. | Epatotossicità |
| FANS orali | Con attenzione per il più breve tempo possibile, solo quando le altre terapie sono fallite. | GI, renale e cardiovascolare |
| FANS topici | Alternativa ai FANS per os, soprattutto se dolore localizzato. | Attenzione in caso di uso concomitante di anticoagulanti |
| Tramadolo | Monitorare eventi avversi. | Stipsi,nausea,sonnolenza,interferenze con altri farmaci |
| Oppiodi | Da considerare per dolore moderato-severo con molto impatto sulle abilità funzionali o QoL, o se fallimento delle altre terapie. | Rischio di cadute e fratture, aumentato rischio di ospedalizzazione,
Stipsi, nausea,letargia |
| Antidepressivi triciclici | Evitare amitriptilina per elevata incidenza di effetti collaterali. | Prolungamento QT, effetti anticolinergici e noradrenergici |
| Antiepilettici | In pazienti con dolore neuropatico. | Sedazione, vertigini |
| SSRI | In pazienti con dolore neuropatico. | Generalmente ben tollerati |
| Lidocaina topica | In pazienti con dolore neuropatico localizzato. | Generalmente ben tollerata, può dare cefalea |
| RACCOMANDAZIONE 10a: Trattare sempre il dolore e ogni sintomo che causa sofferenza accompagnando, quando possibile, la persona nella scelta terapeutica e rispettando la sua volontà. | ||
| RACCOMANDAZIONE 10b: Utilizzare, per il trattamento del dolore cronico nei pazienti anziani, il paracetamolo o, se non efficace, i farmaci oppioidi. Utilizzare antidepressivi e anti-convulsivanti per il trattamento del dolore neuropatico. Non utilizzare gli antinfiammatori non steroidei per il trattamento del dolore cronico nei pazienti anziani. |
La gestione delle infezioni
GianBattista Guerrini, Corrado Carabellese, Daniele Bellandi
Razionale
Le infezioni rappresentano uno dei principali eventi clinici avversi negli anziani ed in particolare nei grandi vecchi. Oltre alla ridotta efficienza età correlata del sistema immunitario e di altri meccanismi difensivi (quali ad esempio il riflesso della tosse, la clearance muco-ciliare, la capacità renale di acidificare le urine, lo svuotamento vescicale, …) aumentano infatti il rischio di infezione la presenza di polipatologia cronica, di dipendenza funzionale, di compromissione cognitiva, di malnutrizione e di alcune patologie più frequenti negli anziani quali il diabete mellito, la BPCO, la presenza di catetere vescicale.
Per quanto riguarda le persone anziane con limitata aspettativa di vita i dati su prevalenza e incidenza delle infezioni derivano principalmente da studi effettuati nei diversi setting di long term care e nei pazienti affetti da demenza. Elaborando i dati di 2 survey nazionali condotte nelle Nursing Home (NH), nei servizi domiciliari e negli hospice statunitensi, Dwyer e collaboratori (Dwyer et al., 2013) segnalano una prevalenza intorno al 10% in tutta la popolazione esaminata. Tra gli ultra85enni la prevalenza di infezioni è 11.7% nelle NH, 8.1% tra coloro che sono assistiti a domicilio e del 11.5% negli hospice. NeIlo studio CASCADE (Mitchell et al., 2006) è descritto il decorso clinico della demenza avanzata in 323 residenti in NH seguiti per 18 mesi. La sopravvivenza mediana era di 1,3 anni. Le più comuni complicanze cliniche erano la difficoltà nell’alimentazione (86%), episodi febbrili (53%) e polmonite (41%). Nello studio SPREAD (Mitchell et al., 2013) per circa la metà di 362 residenti in NH seguiti per 12 mesi vi era il sospetto diagnostico di un’infezione, prevalentemente del tratto urinario o respiratorio.
Il ricorso alla terapia antibiotica è riscontrato nel 27% dei soggetti ricoverati in hospice nell’ultima settimana di vita (Albrecht et al., 2013) e nel 42% dei soggetti istituzionalizzati con demenza avanzata nelle ultime due settimane di vita (D’Agata & Mitchell, 2008).
Negli anziani, ed in particolare nei soggetti più fragili o affetti da deterioramento cognitivo, si osserva una maggiore difficoltà ad operare una diagnosi corretta di infezione sia sul piano clinico sia sul piano strumentale, con un aumentato rischio di utilizzo inappropriato di antibiotici.
Nelle strutture residenziali ogni anno è sottoposta ad uno o più cicli di terapia antibiotica oltre la metà degli ospiti, con tassi di inappropriatezza oscillanti tra il 25% ed il 75%. L’utilizzo potenzialmente inappropriato degli antibiotici interessa in particolare il trattamento delle sospette infezioni delle vie urinaria, anche per la scarsa attendibilità dei segni e sintomi di infezione (D’Agata et al., 2013); la batteriuria asintomatica ne rappresenta il motivo principale (Parsons, 2017).
L’inappropriato ricorso alla terapia antibiotica oltre a contribuire alla comparsa di ceppi batterici multiresistenti può esporre i pazienti, soprattutto i più instabili sul piano clinico e funzionale, a disagi non necessari (Yates et al., 2015). La letteratura sottolinea pertanto l’esigenza di un più ampio utilizzo nella pratica clinica dei criteri diagnostici di infezione, quali, ad esempio, i criteri di McGeer (Stone et al., 2012), oltre che lo sviluppo di criteri specifici per le persone affette da demenza (Mitchell et al., 2014).
Quesito 11: È appropriata la terapia antibiotica nell’anziano con aspettativa di vita limitata?
Ferma restando la necessità di una maggior accuratezza diagnostica, la decisione sul ricorso alla terapia antibiotica può avere come obiettivo l’allungamento della vita e/o il miglioramento della qualità della vita.
I dati sull’impatto della terapia antibiotica sulla sopravvivenza, soprattutto nei pazienti nelle fasi terminali della vita, sono contradditori. In uno studio prospettico condotto su 323 ospiti di RSA (Givens et al., 2010) gli anziani con sospetta polmonite trattati con antibiotico vivevano più a lungo dei non trattati. Al contrario, secondo uno studio condotto su un sottogruppo di 110 ospiti di nursing home dello studio SPREAD, che nel corso di un anno avevano avuto almeno una sospetta infezione delle vie urinarie, il trattamento antibiotico non è risultato associato con l’allungamento della vita (Dufour et al., 2015). Qualora il desiderio espresso dalla persona sia vivere il più a lungo possibile, l’intervento del medico deve tendere a salvaguardare la qualità della vita – e della morte – e a ridurre al minimo disagio e sofferenza, sia nella fase diagnostica sia nella scelta della modalità di somministrazione della terapia. Nella prospettiva, condivisa con la persona, della comfort care, l’obiettivo del trattamento antibiotico è la riduzione dei sintomi che possono causare sofferenza o disagio. La letteratura non offre, in proposito, indicazioni definitive.
Un trattamento aggressivo delle infezioni non associato ad un approccio palliativo peggiora la qualità di vita (Hurley et al. 1993). Secondo il citato studio di Givens e collaboratori (Givens et al., 2010) la terapia antibiotica di una sospetta polmonite aumenta la sopravvivenza, non il comfort, nei soggetti trattati rispetto ai non trattati; un trattamento più aggressivo sarebbe al contrario associato a maggiore disagio. In 193 soggetti con demenza e polmonite ospiti di strutture residenziali olandesi il livello – molto elevato – di sofferenza (dolore e dispnea) non differisce significativamente tra chi viene trattato o meno con antibiotici (Van Der Maaden et al., 2016). Al contrario in un altro studio su 559 soggetti con demenza e polmonite, sempre condotto in Olanda, la terapia antibiotica si associa in maniera indipendente alla riduzione del discomfort (Van Der Steen et al., 2009). La questione non trova al momento una risposta conclusiva, che può essere fornita da trial accuratamente disegnati che confrontino il controllo dei sintomi e la sopravvivenza in soggetti trattati con antibiotici o con cure palliative di alta qualità (Juthani-Mehta et al., 2015).
| RACCOMANDAZIONE 11a: Utilizzare sistematicamente nella pratica clinica appropriati criteri diagnostici nei diversi quadri infettivi. |
| RACCOMANDAZIONE 11b: Prescrivere il trattamento antibiotico nel sospetto clinico che sia l’infezione la causa di dolore, dispnea o altri sintomi, attuando in ogni caso interventi palliativi per ridurre la sofferenza della persona. |
GLI INTERVENTI DI SUPPORTO ALLA FAMIGLIA
Paola Ponton, Ermellina Zanetti, Cinzia Bertelli, Simonetta Di Meo, Serena Sperotto
Razionale
Sostenere la famiglia è un aspetto fondamentale delle cure palliative: i familiari svolgono un ruolo centrale nel fornire assistenza, nonostante il contributo del personale sanitario e indipendentemente dal fatto che la persona assistita sia a casa o in un contesto sanitario formale (Lopez Hartmann et al., 2012). L’assistenza informale da parte di caregiver familiari costituisce uno dei pilastri più noti delle cure a lungo termine in Italia. Per caregiver familiare si intende solitamente una persona che fornisce aiuto a un familiare nelle attività della vita quotidiana o in quelle strumentali così come nella gestione delle cure, nell’accompagnamento e in altre attività di supporto. In Italia, così come in altri Paesi dell’Europa meridionale, esiste una generale accettazione e preferenza culturale del fatto che la famiglia sia incaricata della cura all’anziano: l’8,6% della popolazione italiana adulta risulta impegnata in attività assistenziali gratuite, con percentuali più alte nel Centro Italia (Network Non Autosufficienza, 2015).
I familiari forniscono cure personalizzate, supporto affettivo, sociale e finanziario e se il luogo di cura è il domicilio, garantiscono continuità, gestione dei sintomi e somministrazione di farmaci.
Il caregiving può essere gratificante quando ci si prende cura di chi ha bisogno: i familiari infatti sentono di aver migliorato la qualità della vita per una persona cara. A volte, tuttavia, il peso può provocare esaurimento fisico ed emotivo, emozioni conflittuali, modifiche nella vita del caregiver e un notevole investimento di risorse finanziarie.
Il grande anziano e il suo caregiver rappresentano una diade che richiede necessariamente uno sguardo congiunto per la reciproca interdipendenza ampiamente documentata in letteratura (Adelman et al., 2014). Il paradigma dell’accompagnamento e i modelli di presa in carico per le cure palliative impongono un’attenzione etica anche nei riguardi dei familiari e dei caregiver formali.
Soprattutto nelle cure domiciliari il richiamo è alla vigilanza rispetto al possibile “hidden patient”, il paziente nascosto, rappresentato dal caregiver.
I dati demografici sulla strutturazione delle famiglie italiane odierne nell’ultima fase del ciclo di vita evidenziano la fragilità di sistemi minimali per numero di componenti e con membri in età avanzata e quindi costituzionalmente a maggior rischio: sovente, infatti, i caregiver sono essi stessi persone anziane con problemi di salute (Network Non Autosufficienza, 2013).
Gli interventi per supportare i caregiver sono stati sviluppati e implementati con i seguenti obiettivi generali:
- ridurre la fatica dei caregiver, ad esempio offrendo servizi di sollievo;
- migliorare le capacità di coping, ad esempio fornendo programmi che facilitino la risoluzione dei problemi;
- migliorare il benessere, ad esempio fornendo programmi psicologici come consulenza, rilassamento e psicoterapia;
- fornire gli interventi al momento opportuno.
Quesito 12: Quali interventi di supporto al caregiving sono efficaci?
Valutare il sistema famigliare
Un adeguato supporto al sistema famigliare presuppone una preliminare valutazione del sistema stesso e l’analisi di bisogni, aspettative e capacità dei diversi membri ed in particolare una misura del carico assistenziale (Limpawattana et al., 2013).
Essa non si configura come un giudizio di idoneità ma come una valutazione complessiva volta alla commisurazione e alla programmazione del progetto terapeutico-assistenziale, della tipologia e della organizzazione dell’assistenza e del setting di cura. Deve prevedere pertanto una analisi iniziale e periodici monitoraggi, in particolare nei momenti di cui vi siano dei cambiamenti significativi dello status del paziente o del caregiver. L’obiettivo della pianificazione condivisa del percorso di cura e assistenza si declina infatti nella sostenibilità dello stesso sulla base sia dei desideri dell’anziano o dei suoi caregiver che delle effettive possibilità di tenuta del sistema.
La valutazione multidimensionale deve coinvolgere l’équipe nel suo insieme: ogni professionista può portare un contributo nell’ottica e con gli strumenti propri di ciascuna professionalità.
Ogni sistema familiare è inserito in un contesto ambientale domiciliare – definito dalla struttura di residenza, dal numero di membri familiari coinvolti, dallo status sociale ed economico, dallo stato di salute fisica dei suoi membri, dall’eventuale presenza di membri con particolari fragilità (grandi anziani, disabili, minori) – e si avvale delle risorse della comunità rappresentate dalle reti di supporto formale e informale (sanitarie e sociali). Esso si fonda sui legami familiari, sui valori, sulle credenze e sugli atteggiamenti storicamente strutturati per la definizione dell’identità familiare: in questo contesto si inserisce pertanto la valutazione delle risorse e delle criticità proprie del sistema. E’ necessaria una lettura delle risorse e dei bisogni relazionali, emotivi e affettivi, che comprendano le capacità di coping, ovvero la modalità di far fronte agli eventi stressanti, e la possibile resilienza che i singoli membri o il sistema potrebbero manifestare nella cronicità e nei momenti di acuzie.
Le famiglie si avvalgono, per alcuni compiti di tipo socio-assistenziale e domestico (preparazione dei pasti, governo della casa) delle assistenti familiari o badanti: si stima che in Italia ci siano oltre 800.000 assistenti familiari nella maggior parte dei casi migranti di solito senza alcuna formazione nella cura e nell’assistenza. In presenza di un’assistente familiare, che nella maggior parte dei casi convive con l’assistito, la famiglia si riserva alcuni compiti dei quali desidera mantenere il controllo, in particolare gestione delle finanze, organizzazione dell’assistenza e trasporto. La convivenza predispone l’assistente familiare ad un maggior coinvolgimento in tutte le attività esponendola alla fatica del compito di cura (Network Non Autosufficienza, 2015). Pertanto nei paragrafi seguenti verrà utilizzato il termine caregiver per indicare colui o (più frequentemente) colei su cui grava il compito della cura quotidiana e continuativa.
Valutare l’alfabetizzazione sanitaria nei caregiver informali
La valutazione delle conoscenze e delle competenze cognitive ed in particolare della health literacy permette la conseguente commisurazione degli interventi sia di tipo comunicativo, in particolare nella logica della comunicazione progressiva e della pianificazione condivisa delle cure, sia di tipo educativo dei curanti. La sottostima di questi ultimi aspetti è causa infatti di una sopravvalutazione delle capacità dei caregiver di comprendere e gestire informazioni sanitarie con conseguenze critiche sul piano della aderenza ai processi di cura.
Il concetto di alfabetizzazione sanitaria o Health Literacy (HL) si riferisce primariamente alle “abilità cognitive e sociali che determinano la motivazione e le capacità degli individui di accedere alle informazioni, di comprenderle e di utilizzarle in modo da promuovere e mantenere una buona salute” (World Health Organization, 1998).
La HL è stata inserita in vari documenti di politica sanitaria quali l’European Healt Policies “Health 2020” poiché la misurazione di tali competenze è ritenuta una componente nei processi di identificazione dei temi o delle popolazioni che richiedono maggiori attenzioni nell’ambito sanitario (World Health Organization, 2013). I problemi associati ad una inadeguata alfabetizzazione sanitaria possono infatti produrre outcome negativi, sia a livello individuale che sociale (Speros, 2005). Le popolazioni a rischio sono i gruppi socio-economicamente svantaggiati, i migranti e le minoranze etniche, gli anziani, le persone con patologie croniche e i disabili (Kountz, 2009)
Conoscere il livello di alfabetizzazione dei pazienti anziani e dei loro caregiver informali è stato evidenziato e approfondito dallo studio di Garcia (Garcia et al., 2013), mentre lo studio di Lindquist (Lindquist et al., 2011) ha analizzato la HL in un campione di caregiver non familiari, “le badanti”. Entrambi gli studi sottolineano che i caregiver si occupano di somministrare farmaci, organizzare le cure, condividere le decisioni con i curanti: processi e compiti che richiedono abilità specifiche, di cui frequentemente non sono portatori adeguati. Alcune variabili, di frequente riscontro nella diade paziente anziano/caregiver informale, quali l’età avanzata, un generale stato di salute compromesso, situazioni di cronicità, bassi livelli di scolarizzazione, basso reddito e scarsa consapevolezza delle condizioni di salute correlano con inadeguati livelli di HL (Connor et al., 2013; Gazmararian et al., 1999; Speros, 2005). Tale situazione costituisce internazionalmente uno dei maggiori problemi di politica sanitaria poiché bassi livelli di HL peggiorano gli outcome delle cure (efficacia, morbilità e mortalità), aumentano il numero di ricoveri, gli accessi ai servizi di emergenza e i costi delle cure, e riducono l’uso adeguato dei servizi sanitari, il dialogo interlocutorio con i curanti, l’efficacia degli interventi di continuità delle cure. Viceversa un caregiver con un adeguato livello di HL può migliorare l’aderenza alle terapie, l’interpretazione delle informazioni mediche, la comunicazione con i sanitari e la presa di decisioni nei percorsi di cura con maggior consapevolezza e supporto all’autodeterminazione.
La ricerca su tali questioni è ancora piuttosto limitata, tuttavia come evidenzia lo studio di Garcia et al (Garcia et al., 2013), in coerenza con studi precedenti, nella popolazione anziana di lingua ispanica negli Usa, bassi livelli di HL si ritrovano in una larga prevalenza di anziani (64,9%) e in una pecentuale inferiore di caregiver (31%). Si ritiene che compromissioni cognitive e del visus, età, bassi livelli di scolarizzazione e di acculturazione possono essere considerati come segnali di allerta per i sanitari per l’attivazione di strumenti di prevenzione dei rischi concorrenti. Interessante il quadro concettuale (vedi figura) proposto da Garcia et al per la lettura dell’intreccio delle variabili da considerare nell’analisi della HL di paziente e caregiver.
Figura 1. Possibili variabili da considerare nell’analisi della HL di paziente e caregiver (Garcia et al., 2013).
La HL è una costrutto misurabile. Dagli anni ’90 dello scorso secolo sono stati messi a punto diversi strumenti per la sua misurazione (Duell et al., 2015):
- European Health Measurement Instrument (EU-HLS) (Sorensen et al., 2012)
- Health Literacy Measurement Instrument (HLS-EU-Q) (Sorensen et al., 2015)
- Health Literacy Management scale (HeLMs) (Jordan et al., 2013)
- il Rapid Estimate of Adul Literacy in Medicine (REALM) (Murphy et al., 1993)
- il Test of Functional Healt Literacy (TOFLHA) (Parker et al., 1995) e la sua forma breve Short Test of Functional Health Literacy in Adults (S-TOFHLA) (Baker et al., 1999)
- e il più recente Newest Vital Sign (NVS) (Ciccarelli et al., 2010).
Il TOFLHA nella versione breve e il recente NVS sono strumenti validati in lingua italiana (Capecchi et al., 2015; Connor et al., 2013).
Lo screening periodico per valutare l’alfabetizzazione sanitaria, utilizzando uno strumento tra quelli proposti in letteratura, non ha tuttavia dimostrato di migliorare i risultati e non è raccomandato (Hersh et al., 2015; Paasche-Orlow & Wolf, 2008). Più organizzazioni, tra queste l’American Medical Association e l’Agency for Health Care Research and Quality raccomandano l’uso di precauzioni universali di alfabetizzazione sanitaria per fornire informazioni comprensibili e accessibili a tutti, indipendentemente dalla loro alfabetizzazione o dai livelli di istruzione. Ciò include l’evitare il gergo medico, scomporre le informazioni e le istruzioni in piccoli passi concreti, limitare l’attenzione durante una visita a tre punti chiave o attività e valutarne la comprensione. Le informazioni stampate devono essere scritte in stampatello font 14 e l’utilizzo di ausili visivi, come grafici o immagini, può migliorare la comprensione (Hersh et al., 2015; Nielsen-Bohlman et al., 2004; Paasche-Orlow & Wolf, 2008).
Valutare il burden del caregiving
Elena Lucchi – Psicologa presso la Fondazione Teresa Camplani Casa di Cura “Ancelle della Carità” di Cremona
Poichè gli interventi di supporto ai caregiver sono efficaci se mirati alle reali esigenze, bisogni e caratteristiche del caregiver, emerge in modo evidente la necessità di misurare le variabili legate alla sofferenza (burden, sintomi psicologici, stress, ecc), nonchè i bisogni specifici e le risorse stesse del caregiver (coping, disponibilità socio-economiche) necessarie per fare fronte a un compito impegnativo come quello dell’assistenza.
Il Caregiver Burden (CB) è definito da Zarit e collaboratori (Zarit et al., 1986) come “il grado in cui i caregiver percepiscono che il caregiving ha avuto un effetto negativo sul loro funzionamento emotivo, sociale, finanziario, fisico e spirituale”, delineando subito la caratteristica multidimensionale e la soggettività dell’esperienza del burden (Gillick, 2013). Il CB rappresenta uno dei problemi più rilevanti che colpisce i caregiver di anziani malati cronici (Adelman et al., 2014).
Tra i maggiori fattori di rischio per lo sviluppo del CB troviamo il genere femminile, il basso livello di istruzione, la convivenza con l’assistito, il maggior numero di ore di caregiving, la depressione, l’isolamento sociale, lo stress finanziario, la mancanza di scelta nell’assistere la persona (Adelman et al., 2014) e l’uso di un minor numero di strategie di coping (Kim et al., 2012). Poichè il 90% dei caregiver familiari è donna, emerge con ancora più evidenza la necessità di rilevare il CB.
Un’indagine sul CB effettuata dal National Alliance for Caregiving (NAC) e dal Public Policy Institute (Raley & Smith, 2015)ha dimostrato che il 40% dei caregiver ha un alto carico di burden e il 18% ha un burden medio (basato sulla rilevazione del tempo trascorso nell’assistenza e il grado di dipendenza dell’assistito), confermando la rilevanza del problema nell’attività di cura.
Il CB è un indicatore dell’effetto che l’assistenza ha sul benessere psicofisico del caregiver e, di conseguenza, della possibilità del caregiver stesso di continuare a svolgere in modo adeguato e sicuro il compito di assistenza.
Sebbene la valutazione degli aspetti clinici, psicologici e sociali sia un elemento centrale in una cura di qualità per le persone anziane, il riconoscimento e la valutazione della salute e del benessere del caregiver non è effettuato di routine (Collins & Swartz, 2011). Ancora oggi il CB è un aspetto troppo poco rilevato e misurato nella pratica clinica.
Un’adeguata valutazione del caregiver dovrebbe portare all’identificazione di fattori che possono causare disagio, come ad esempio eccessive richieste fisiche, negative conseguenze psicologiche del prendersi cura, conflitti familiari, problemi economici, disturbi comportamentali fonte di stress (Aldrich, 2009)
La Figura 2 fornisce una serie di argomenti e domande consigliati per guidare la valutazione dei caregiver. L’assessment del caregiver fornirà informazioni fondamentali per aiutare l’équipe interdisciplinare a creare un piano di cura coerente, completo, individualizzato per la persona e il caregiver.
Non bisogna dimenticare che l’eperienza del CB può differire sia qualitativamente che quantitativamente a seconda della patologia della persona assistita (persona con demenza, cancro, stroke, trauma cranico, SLA, Parkinson, fragilità fisica, ecc), oltre che in base a caratteristiche personali del caregiver stesso (Kim & Schulz, 2008).
La National Consensus Development Conference for Caregiver Assessment (Family Caregiver Alliance (FCA), 2006a, 2006b) raccomanda il seguente approccio ai caregiver:
- identificare i caregiver primari e secondari;
- considerare, lungo tutto il percorso di cura, i bisogni e le preferenze sia della persona sia del caregiver;
- migliorare la comprensione del ruolo da parte dei caregiver e insegnare loro le abilità necessarie per svolgere i compiti di caregiving;
- riconoscere la necessità di una valutazione longitudinale e periodica dei risultati dell’assistenza per la persona e per il caregiver.
Oltre all’approccio sopra menzionato, la valutazione dovrebbe esplorare il senso di benessere del caregiver, la fiducia nelle proprie capacità di fornire assistenza e la necessità di ulteriore supporto.
Esistono numerosi strumenti di valutazione del CB, che vanno scelti in base alla popolazione che si intende valutare (caregiver di persone con demenza, con Parkinson, ospedalizzate, con tumore, ecc) o in base alle dimensioni di CB che si intendono rilevare (burden emotivo, sovraccarico di stress, burden mentale, autostima, burden fisico, burden familiare e finanziario, burden di ruolo) (Große et al., 2018; Ringer et al., 2017). Tra i più utilizzati lo Zarit Burden Interview è stato classificato come una misura globale di CB perché valuta il benessere psicofisico, le finanze, la vita sociale e il rapporto tra il caregiver e la persona con disabilità (Zarit, Reever, & Bach-Peterson, 1980). É disponibile la versione validata in lingua italiana (Chattat et al., 2011).
Anche il Caregiver Burden Inventory (Novak & Guest, 1989) è uno strumento multidimensionale del quale esiste una validazione in lingua italiana (Marvardi et al., 2005)
Tra gli strumenti italiani: il Caregiver Needs Assessment di Moroni e collaboratori (Moroni et al., 2008), costruito per indagare quanto alcuni bisogni siano percepiti dal caregiver di un soggetto con elevata disabilità in particolare nei primi momenti di assunzione del ruolo; il Family Strain Questionare (FSQ) (Rossi Ferrario et al., 2001, 2004) che esamina le problematiche caregiving-correlate, indipendentemente dalla patologia; il Disease Impact On Caregiver (Tiozzo et al, 2002) che rileva l’impatto sulla qualità di vita del caregiver di differenti patologie croniche dell’assistito.
Per una trattazione completa degli strumenti si rimanda alla review del 2012 di Van Durme e collaboratori (Van Durme et al., 2012).
Figura 2. Argomenti e domande selezionate per la valutazione del caregiver (Adelman et al. 2014).
Supportare il/i caregiver
La revisione della Cochrane (Candy et al., 2011) ha selezionato undici studi randomizzati e controllati che hanno valutato l’efficacia degli interventi di supporto sulla salute psicologica (affrontare il ruolo di cura, il disagio psicologico, la qualità della vita) e fisica (qualità del sonno) dei caregivers informali di persone nella fase finale della loro malattia. I caregiver (1836) erano coniugi o figli adulti. L’età media dei caregiver era compresa tra 50 e 65 anni. Gli assistiti avevano un’età media compresa fra 54 e 71 anni ed erano persone nella fase finale della loro vita, con una prognosi compresa tra 6 mesi e 1 anno, o con una condizione avanzata di malattia, declino funzionale, o già in cure palliative.
Gli interventi diretti al caregiver erano distinti dall’assistenza o dalla fornitura di servizi al paziente e consistevano in consulenza e supporto, agevolazione delle capacità di risoluzione dei problemi, sostegno emotivo, consulenza finanziaria, istruzioni per la cura del paziente ed erano erogati da infermieri, assistenti sociali, terapisti familiari. Gli interventi prevedevano da due a nove sessioni di contatto. Un intervento è stato fornito anche dopo la morte del paziente.
Gli interventi indiretti, erogati da infermieri, supportavano i caregiver attraverso la cura del paziente: gli infermieri valutavano i bisogni e pianificavano gli interventi attivando per tempo i professionisti o i servizi necessari.
Gli autori concludono affermando che, sebbene non sia chiaro quale modalità di supporto possa essere di maggior beneficio, il supporto emotivo e le informazioni sulla gestione della cura della persona cara sono caratteristiche comuni degli interventi che si sono dimostrati utili per “tamponare” il disagio psicologico. Gli autori invitano gli operatori sanitari ad informarsi in merito alla preoccupazioni dei caregiver e a considerare che essi possono beneficiare di ulteriore sostegno per far fronte al loro compito di cura.
La revisione di Lopez-Hartmann e colleghi (Lopez Hartmann et al., 2012) valuta l’efficacia degli interventi di supporto rivolti ai cargiver di anziani fragili che vivono a casa.
Il caregiver, in questa revisione, è la persona che fornisce assistenza ad un parente, amico o vicino che ha bisogno di cure a lungo termine e che ha una relazione personale con il destinatario dell’assistenza. L’anziano fragile è una persona anziana vulnerabile che vive ancora a casa ma che dipende da altri per una o più attività della vita quotidiana (ADL) a lungo termine. La fragilità non è legata a condizioni specifiche.
Gli autori attraverso la revisione sistematica di 4 review e 10 studi primari concludono affermando che nel complesso, l’effetto degli interventi di supporto al caregiver è di modesta entità e anche incoerente tra gli studi. La “respite care”fornisce al caregiver una pausa temporanea nelle sue attività di caregiving e può essere utile per ridurre la depressione, il burden e la rabbia. Gli interventi individuali di supporto, attraverso il counselling, il supporto emotivo, la formazione, lo sviluppo di competenze riducono la depressione di chi si prende cura e migliorano l’assistenza. Gli interventi di gruppo, oltre alle caratteristiche degli interventi a livello dei singoli caregiver, hanno anche una dimensione sociale: l’interazione tra i membri del gruppo può avere un effetto sui caregiver che è impossibile ottenere con il supporto individuale. Gli interventi di gruppo diminuiscono la depressione e l’ansia, aumentano la conoscenza delle risorse della comunità e aumentano il sostegno sociale. Non sono stati osservati effetti sul burden.
L’Information and Communication Technology può essere utilizzata per il supporto ai caregiver: un netto vantaggio degli interventi basati sulla tecnologia è la possibilià per il caregiver di accedere al supporto e alle informazioni 24 ore al giorno dalle propria abitazione. Cassie & Sanders, (2008) hanno esaminato l’uso dei servizi telefonici e informatici per fornire assistenza e istruzioni ai caregiver a domicilio e hanno osservato che gli interventi basati sulla tecnologia potrebbero ridurre la depressione, il burden e l’ansia.
Lopez-Hartmann e colleghi (Lopez Hartmann et al., 2012) suggeriscono che gli interventi integrati selezionati e adattati in base alle esigenze fisiche, psicologiche e sociali dei singoli caregiver dovrebbero essere preferiti quando si tratta di aiutare i caregiver informali di anziani fragili. Ciò richiede un’intensa collaborazione e coordinamento tra tutte le parti coinvolte.
L’articolo di Doris Yu (Yu, 2016) descrive i risultati preliminari di uno studio randomizzato controllato sugli effetti di un modello di case management socio sanitario rivolto ai caregiver di anziani fragili. Il modello è stato sviluppato a partire dai risultati della revisione di Lopez-Hartmann (Lopez Hartmann et al., 2012) e prevede:
- La valutazione del bisogno di assistenza del caregiver e delle risorse esistenti per individuare gli interventi di supporto in base alle esigenze specifiche del singolo caregiver. Per i caregiver la valutazione considera le mansioni quotidiane di caregiving, la durata del caregiving e la competenza percepita, la volontà e la disponibilità a svolgere il ruolo di caregiving, la qualità del rapporto con il familiare assistito e l’effetto del caregiving sulla percezione della salute complessiva. La valutazione degli assistiti prende in considerazione la funzione fisica e cognitiva, lo stato nutrizionale, le malattie, i sintomi e le terapie in atto. Al termine della valutazione i valutatori esaminano criticamente i risultati per identificare eventuali discrepanze nelle richieste di assistenza e nelle risorse a disposizione e stilano un elenco di problemi prioritari per ciascun caregiver al fine di orientare le successive strategie di supporto all’assistenza.
- Interventi integrati e ben coordinati con una collaborazione multidisciplinare per sviluppare e sostenere le competenze di caregiving e ottimizzare la continuità del supporto: in base ai bisogni prioritari rilevati il case manager può essere un infermiere o un assistente sociale. Il case manager contatta telefonicamente il caregiver ogni 4 settimane per fornire consulenza in base all’elenco dei problemi, verificare eventuali ostacoli ad un’assistenza efficace e sviluppare interventi per risolverli.
- Un supporto di gruppo per fornire una dimensione sociale e per ottimizzare il supporto informativo, emotivo e sociale tra pari: sono previsti dei seminari di formazione su problemi comuni identificati nella valutazione globale. I seminari sono affidati ad un gruppo multidisciplinare composto da infermieri, assistenti sociali, un nutrizionista e un fisioterapista. Il case manager nei contatti con il caregiver rafforza il contenuto educativo e incoraggia il trasferimento delle conoscenze nel contesto di cura.
Lo studio ha coinvolto 60 caregiver (età media 61,3 + 15,5; più del 70% erano donne e circa la metà figli della persona assistita; il ruolo di caregiver durava da più di 3 anni) e 60 assistiti (età media 83,3 + 8.3; molteplici comorbilità e almeno un livello moderato di compromissione funzionale). I caregiver risiedevano presso lo stesso domicilio del loro assistito e fornivano assistenza giornaliera per 6 ore o più al giorno. 30 caregiver sono stati supportati secondo il modello di case management socio sanitario per 16 settimane e gli altri 30 ricevevano gli interventi di supporto usuali (consulenza generale sui problemi di cura che gli assistenti sociali fornivano su richiesta del caregiver).
I caregives familiari supportati secondo il modello di case management socio sanitario hanno ottenuto un miglioramento significativamente maggiore del Caregiver Burden Index (p = 0,03) e delle sottoscale del Medical Outcomes Study 36-item Short-Form Survey, inclusa la vitalità (p = .049), il funzionamento del ruolo sociale (p = .047) e il benessere generale (p = .049).
Lo studio fornisce prove preliminari che indicano che la collaborazione tra operatori sanitari e sociali, insieme ad un approccio di case management, sono cruciali per un sostegno al caregiving efficace. Gli autori concludono affermando che é necessario uno studio su vasta scala per fornire evidenze di buona qualità sull’efficacia del modello.
| RACCOMANDAZIONE 12a: Considerare le risorse del sistema famigliare, i bisogni relazionali, emotivi e affettivi, la possibile resilienza dei singoli membri, le preoccupazioni e le aspettative dei caregiver al fine di pianificare gli interventi di supporto. |
| RACCOMANDAZIONE 12b: Considerare il livello di alfabetizzazione sanitaria e di istruzione dei caregiver per fornire informazioni comprensibili e utilizzabili; tuttavia nessuno strumento di valutazione dell’alfabetizzazione sanitaria tra quelli proposti in letteratura ha dimostrato di migliorare i risultati. |
| RACCOMANDAZIONE 12c: Valutare le potenzialità di adattamento e i fattori di rischio legati alle caratteristiche del caregiver e del sistema famigliare (burden, benessere, salute e risorse individuali, sociali, relazionali, economiche). |
| RACCOMANDAZIONE 12d: Pianificare interventi di sostegno al compito di cura dei caregiver. |
| RACCOMANDAZIONE 12e: Adottare un modello di case management affidando il compito di case manager ad un professionista con le competenze necessarie a rispondere ai bisogni espressi dalla persona e dal suo caregiver. |
| RACCOMANDAZIONE 12f: Promuovere la collaborazione tra professionisti sanitari e sociali per pianificare interventi integrati di supporto al caregiver. |
Glossario degli acronimi
- ADEPT: Advanced Dementia Prognostic Tool (ADEPT
- ADL: Activities of Daily Living
- AGDHA: dall’Australian Government Department of Health and Ageing
- AGS: American Geriatric Society
- AUC: Area Under the Curve ROC – Receiver Operating Characteristics
- BANS-S: Bedford Alzheimer Nursing Severity Scale
- BMI: Body Mass Index
- CAP: Protocolli di valutazione del Cliente
- CB: Caregiver Burden
- CDR: Clinical Dementia Rating Scale
- CI: Intervallo di Confidenza
- CPAT: CNA Pain Assessment tool
- CIRS: Comorbidity Index Rating Scale
- DE: Dipartimento di Emergenza
- DSM-IV: Diagnostic and Statistical manual of Mental disorders —4th edityion
- EAPC: European Association for Palliative Care
- EU-HLS: European Health Measurement Instrument
- FAST: Functional Assessment STaging scale
- FCA: Family Caregiver Alliance
- FPS: Face Pain Scale
- GSF: Gold Standards Framework
- HeLMs: Health Literacy management scale
- HL: Health Literacy
- HLS-EU-Q: Health Literacy Measurement Instrument
- IADL: Instrumental Activities of Daily Living
- interRAI PC: interRAI Palliative Care instrument
- MMSE: Mini-Mental State Examination
- MNA: Mini Nutritional Assessement
- MOBID-2: Mobilization-Observation-Behaviour-Intensity-Dementia pain scale –
- MPI: Multidimensional Prognostic Index
- MQLS: McMaster Quality of Life Scale
- mQOLC-E: Modified Quality of Life Concerns in the End of Life Questionnaire
- MVQOLI–R : Missoula-VITAS Quality of Life Index – Revised
- NAC: National Alliance for Caregiving
- NECPAL-CCOMS-ICO tool: NECesidades PALiativas tool
- NICE: National Institute for Health and Care Excellence
- NOPPAIN: Non-Communicative Patients’ Pain Assessment Instrument
- NPUAP: National Pressure Ulcer Advisory Panel
- NRS: Numeric Rating Scale
- NVS: Newest Vital Sign
- OR: Odd Ratio
- PAINAD: Pain Assessment in Advanced Dementia
- PEG: Gastrostomia Percutanea Endoscopica
- PEGJ: Digiunostomia
- PIG: Prognostic Indicator Guide
- PMI: Multidimensional Prognostic Index
- POS: Palliative care Outcome Scale
- QI: Indicatori di Qualità
- QoL: Quality of Life
- RCT: Randomized Controlled Trial
- RADPAC: RADboud indicators for PAlliative Care needs
- REALM: Rapid Estimate of Adul Literacy in Medicine
- SNG: Sonde NasoGastriche o nasogastrodigiunali
- SPICT: Supportive and Palliative Care Indicators Tool
- SPMSQ: Short Portable Mental Status Questionnaire
- SQ: domanda sorprendete
- S-TOFHLA: Short Test of Functional Health Literacy in Adults
- TOFLHA: Test of Functional Healt Literacy
- VAS: Visual Analogue Scale
- VDS: Verbal Descriptor Scale
- VMD: Valutazione MultiDimensionale
Ritorna alla scheda informativa della Conferenza di Consenso
Bibliografia
Abbey, J., Piller, N., De Bellis, A., Esterman, A., Parker, D., & Giles, L. (2004). A 1-minute numerical indicator for people with end-stage dementia. International Journal of Palliative Nursing, 10(1), 6–13.
AGS Panel on Chronic Pain in Older Persons. (1998). The management of chronic pain in older persons. Journal of the American Geriatrics Society, 46, 635–651.
Albrecht, J. S., McGregor, J. C., Fromme, E. K., Bearden, D. T., & Furuno, J. P. (2013). A Nationwide Analysis of Antibiotic Use in Hospice Care in the Final Week of Life. J Pain Symptom Manage, 46(4), 483–490.
Bear, A. J., Bukowy, E. A., & Patel, J. J. (2017). Artificial Hydration at the End of Life. Nutrition in Clinical Practice,32(5), 628–632.
Brinkman-stoppelenburg, A., Rietjens, J. A. C., & Heide, A. Van Der. (2014). The effects of advance care planning on end-of-life care : A systematic review, (Erasmus MC).
Burns, C. M., Dixon, T., Smith, W. T., & Craft, P. (2004). Patients with advanced cancer and family caregivers’ knowledge of health and community services: A longitudinal study. Health and Social Care in the Community, 12(6), 488–503.
Caccialanza, R., Constans, T., Cotogni, P., Zaloga, GP., Pontes-Arruda, A.( 2018) Subcutaneous Infusion of Fluids for Hydration or Nutrition: A Review. JPEN J Parenter Enteral Nutr.Feb;42(2):296-307.
Cervo, F. A., Bruckenthal, P., Chen, J. J., Bright-Long, L. E., Fields, S., Zhang, G., & Strongwater, I. (2009). Pain Assessment in Nursing Home Residents With Dementia: Psychometric Properties and Clinical Utility of the CNA Pain Assessment Tool (CPAT). Journal of the American Medical Directors Association, 10(7), 505–510.
Cervo, F. A., Raggi, R. P., Bright-long, L. E., Wright, W. K., Rows, G., Torres, A. E., … Komaroff, E. (2007). Current Topics in Management Pain Assessment Tool ( CPAT ) in Nursing. American Journal of Alzheimer’s Disease & Other Dementiasr, 22(2), 112–119.
Costardi D, Rozzini L, Costanzi C, Ghianda D, Franzoni S, Padovani A, Trabucchi M. (2007). The Italian version of the pain assessment in advanced dementia (PAINAD) scale. Arch Gerontol Geriatr. Mar-Apr; 44(2):175-80
Croyère N, Belloir MN, Chantler L, McEwan L. (2012). Oral care in nursing practice: a pragmatic representation. Int J Palliat Nurs. Sep;18(9):435-40;
D’Agata, E., & Mitchell, S. L. (2008). Patterns of Antimicrobial Use Among Nursing Home Residents With Advanced Dementia. Archives of Internal Medicine, 168(4), 357.
D’Agata, E., Loeb, M. B., & Mitchell, S. L. (2013). Challenges Assessing Nursing Home Residents with Advanced Dementia for Suspected Urinary Tract Infections. Journal of the American Geriatrics Society, 61(1), 62–66.
Del Rio, M. I., Shand, B., Bonati, P., Palma, A., Maldonado, A., Taboada, P., & Nervi, F. (2012). Hydration and nutrition at the end of life: a systematic review of emotional impact, perceptions, and decision-making among patients, family, and health care staff. Psycho-Oncology, 21(9), 913–921.
Desbiens, J. F., Gagnon, J., & Fillion, L. (2012). Development of a shared theory in palliative care to enhance nursing competence. Journal of Advanced Nursing, 68(9), 2113–2124.
Di Giulio, P., Toscani, F., Villani, D., Brunelli, C., Gentile, S., & Spadin, P. (2008). Dying with advanced dementia in long-term care geriatric institutions: a retrospective study. J Palliat Med, 11(7), 1023-1028.
Disalvo, D., Luckett, T., Agar, M., Bennett, A., & Davidson, P. M. (2016). Systems to identify potentially inappropriate prescribing in people with advanced dementia: A systematic review. BMC Geriatrics, 16(1).
Dobrina, R., Tenze, M., & Palese, A. (2014). An overview of hospice and palliative care nursing models and theories. International Journal of Palliative Nursing, 20(2), 75–81.
Druml, C., Ballmer, P. E., Druml, W., Oehmichen, F., Shenkin, A., Singer, P., … Bischoff, S. C. (2016). ESPEN guideline on ethical aspects of artificial nutrition and hydration. Clinical Nutrition, 35(3), 545–556.
Dufour, A. B., Shaffer, M. L., D’Agata, E. M. C., Habtemariam, D., & Mitchell, S. L. (2015). Survival After Suspected Urinary Tract Infection in Individuals with Advanced Dementia. J Am Geriatr Soc.,63(12), 2472–2477.
Dwyer, L. L., Harris-kojetin, L. D., Valverde, R. H., Frazier, J. M., Simon, A. E., Stone, N. D., & Thompson, N. D. (2013). Infections in Long-Term Care Populations in the United States, 341–349.
Ferrari, R., Martini, M., Mondini, S., Novello, C., Palomba, D., Scacco, C., … Visentin, M. (2009). Pain assessment in non-communicative patients: The Italian version of the Non-Communicative Patient’s Pain Assessment Instrument (NOPPAIN). Aging Clinical and Experimental Research,21(4–5), 298–306.
Finucane, T., Christmas, C., & Travis, K. (1999). Tube Feeding in Patients With Advanced Dementia A Review of the Evidence. JAMA : The Journal of the American Medical Association, 282(14), 1.
Forbat, L., Kunicki, N., Chapman, M., Lovell, C. (2017) How and why are subcutaneous fluids administered in an advanced illness population: a systematic review. J Clin Nurs. May;26(9-10):1204-1216
Forero, R., McDonnell, G., Gallego, B., McCarthy, S., Mohsin, M., Shanley, C., … Hillman, K. (2012). A Literature Review on Care at the End-of-Life in the Emergency Department. Emergency Medicine International,2012, 1–11.
Fritzson, A., Tavelin, B., & Axelsson, B. (2015). Association between parenteral fluids and symptoms in hospital end-of-life care: An observational study of 280 patients. BMJ Supportive and Palliative Care, 5(2), 160–168.
Gallagher, P., & O’Mahony, D. (2008). STOPP (Screening Tool of Older Persons’ potentially inappropriate Prescriptions): Application to acutely ill elderly patients and comparison with Beers’ criteria. Age and Ageing, 37(6), 673–679.
Givens, J. L., Jones, R. N., Shaffer, M. L., Kiely, D. K., & Mitchell, S. L. (2010). Survival and Comfort After Treatment of Pneumonia in Advanced Dementia. Arch Intern Med, 170(13), 1102–1107.
Gomes, B., Calanzani, N., Curiale, V., Mccrone, P., & Ij, H. (2013). Effectiveness and cost-effectiveness of home palliative care services for adults with advanced illness and their caregivers Cochrane Database Syst Rev. Jun 6;(6)
Good, P., Richard, R., Syrmis, W., Jenkins-Marsh, S., & Stephens, J. (2014). Medically assisted hydration for adult palliative care patients (Review). Cochrane Database of Systematic Reviews, (4), 1–9.
Graverholt, B., Forsetlund, L., & Jamtvedt, G. (2014). Reducing hospital admissions from nursing homes : a systematic review. BMC Health Services Research, 14(1), 1–8.
Hall, S., Davies, E., Frogatt, K., Higginson, I., & Kolliakou, A. (2011). Interventions for improving palliative care for older people living in nursing care homes. Cochrane Database of Systematic Reviews, (2).
Herr, K. (2002). Pain assessment in cognitively impaired older adults. American Journal of Nursing, 102(12), 65–68.
Herr, K. A., & Garand, L. (2001). Assessment and measurement of pain in older adults. Clinics in Geriatric Medicine, 17(3), 457–78, vi
Herr, K. A., Mobily, P., Kohout, F., & Wagenaar, D. (1998). Evaluation of the Faces Pain Scale for Use with the Elderly, 14(1), 29–38.
Higginson, I. J., Finlay, I. G., Goodwin, D. M., Hood, K., Edwards, A. G. K., Cook, A., … Normand, C. E. (2003). Is there evidence that palliative care teams alter end-of-life experiences of patients and their caregivers? Journal of Pain and Symptom Management, 25(2), 150–168.
Holmes, H. M., Sachs, G. A., Shega, J. W., Hougham, G. W., Cox Hayley, D., & Dale, W. (2008). Integrating palliative medicine into the care of persons with advanced dementia: Identifying appropriate medication use.Journal of the American Geriatrics Society, 56(7), 1306–1311.
Houben, C. H. M., Spruit, M. A., Groenen, M. T. J., Wouters, E. F. M., & Janssen, D. J. A. (2014). Efficacy of advance care planning: A systematic review and meta-analysis. Journal of the American Medical Directors Association, 15(7), 477–489.
Hurley, A. C., Volicer, B., Mahoney, M. A., & Volicer, L. (1993). Palliative fever management in Alzheimer patients. quality plus fiscal responsibility. Advances in Nursing Science, 16(1), 21–32.
Husebo, B. S., Achterberg, W., & Flo, E. (2016). Identifying and Managing Pain in People with Alzheimer’s Disease and Other Types of Dementia: A Systematic Review. CNS Drugs, 30(6), 481–497.
Juthani-Mehta, M., Malani, P. N., & Mitchell, S. L. (2015). Antimicrobials at the End of Life: An Opportunity to Improve Palliative Care and Infection Management. JAMA – Journal of the American Medical Association, 314(19), 2017–2018.
Kelly DF, Medical Care at the end of life, Washington, DC, Georgetown University Press, 2006, 103.
Ker, K,, Tansley, G., Beecher, D., et al.(2015) Comparison of routes for achieving parenteral access with a focus on the management of patients with Ebola virus disease. Cochrane Database Syst Rev.;2:CD011386
Kim, Y.I. (2001). To feed or not to feed: Tube feeding in patients with advanced dementia. Nutrition Reviews, 59(3), 86–88.
Kvalheim, S.F., Strand, G.V., Husebø, B.S., Marthinussen, M.C. (2016) End-of-life palliative oral care in Norwegian health institutions. An exploratory study. Gerodontology. Dec;33(4):522-529
Lavan, A. H., Gallagher, P., & O’Mahony, D. (2018). Inter-rater reliability of STOPPFrail [Screening Tool of Older Persons Prescriptions in Frail adults with limited life expectancy] criteria amongst 12 physicians. European Journal of Clinical Pharmacology, 74,331–338.
LEGGE 22 dicembre 2017, n. 219 Norme in materia di consenso informato e di disposizioni anticipate di trattamento. (G.U. n. 12 del 16-1-2018)
Lichtner, V., Dowding, D., Esterhuizen, P., Closs, S. J. J., Long, A. F., Corbett, A., & Briggs, M. (2014). Pain assessment for people with dementia: a systematic review of systematic reviews of pain assessment tools. BMC Geriatrics, 14, 138.
Luckett, T., Phillips, J., Agar, M., Virdun, C., Green, A., & Davidson, P. M. (2014). Elements of effective palliative care models: A rapid review. BMC Health Services Research, 14(1), 1–22.
Makris, U. E., Abrams, R. C., Gurland, B., & Reid, M. C. (2014). Management of persistent pain in the older patient: a clinical review. JAMA – Journal of the American Medical Association, 312(8), 825–36.
McGuire, D. B., Kaiser, K. S., Haisfield-Wolfe, M. E., & Iyamu, F. (2016). Pain Assessment in Noncommunicative Adult Palliative Care Patients. Nursing Clinics of North America, 51(3), 397–431.
Milligan S, McGill M, Sweeney MP, Malarkey C.(2001) Oral care for people with advanced cancer: an evidence-based protocol. Int J Palliat Nurs. Sep;7(9):418-26.
Mitchell, S. L., Kiely, & Hamel, M. B. (2004). Dying with advanced dementia in the nursing home. Arch Intern Med, 164(3), 321-326.
Mitchell, S. L., Kiely, D. K., & Jones, R. N. (2006). Advanced Dementia Research in the Nursing Home: The CASCADE Study. Alzheimer Dis Assoc Disord, 20(3), 166–175.
Mitchell, S. L., Shaffer, M. L., Kiely, D. K., Givens, J. L., & D’Agata, E. (2013). The study of pathogen resistance and antimicrobial use in dementia: Study design and methodology. Archives of Gerontology and Geriatrics, 56(1), 16–22.
Mitchell, S. L., Shaffer, M. L., Loeb, M. B., Jane, L., Habtemariam, D., Kiely, D. K., & Agata, E. D. (2014). Infection Management and Multidrug-Resistant Organisms in Nursing Home Residents With Advanced Dementia. JAMA Intern Med, 174(10), 1660–1667.
Mitchell, S. L., Teno, J.M., Kiely, D. K., Shaffer, M. L., Loeb, Jones, R. N., Prigerson, H. G., Volicer, L., Givens, J. L., & Hamel, M. B. (2009). The Clinical Course of Advanced Dementia. N Engl J Med, 361(16), 1529–1538.
Morita, T., Hyodo, I., Yoshimi, T., Ikenaga, M., Tamura, Y., Yoshizawa, A., … Adachi, I. (2005). Association between hydration volume and symptoms in terminally ill cancer patients with abdominal malignancies, Ann Oncol,16(4), 640-7
Morrison, R. S., Penrod, J. D., Cassel, J. B., Caust-Ellenbogen, M., Litke, A., Spragens, L., & Meier, D. E. (2008). Cost savings associated with U.S. hospital palliative care consultation programs.Arch Intern Med.168(16,1783-1790
Murphy, E., Froggatt, K., Connolly, S., Shea, O. E., El, S., Casey, D., & Devane, D. (2016). Palliative care interventions in advanced dementia. Cochrane Database of Systematic Reviews, (12), 1–48.
Murray, M. A. (2007). Crossing over: transforming palliative care nursing services for the 21st century. International Journal of Palliative Nursing, 13(8), 366–76
Nakajima, N., Satake, N., & Nakaho, T. (2014). Indications and practice of artificial hydration for terminally ill cancer patients. Current Opinion in Supportive and Palliative Care, 8(4), 358–363.
NICE guideline [NG97] Dementia: assessment, management and support for people living with dementia and their carers Published date: June 2018
Novello, C., Ferrari, R., Scacco, C., & Visentin, M. (2009). La versione italiana della scala NOPPAIN: Validazione in un contesto di formazione. Assistenza Infermieristica E Ricerca, 28(4), 198–205.
Onder, G., Liperoti, R., Fialova, D., Topinkova, E., Tosato, M., Danese, P., … Landi, F. (2012). Polypharmacy in nursing home in Europe: Results from the SHELTER study. Journals of Gerontology – Series A Biological Sciences and Medical Sciences, 67 A(6), 698–704.
PANEL AGS. (2015). American Geriatrics Society 2015 updated beers criteria for potentially inappropriate medication use in older adults. Journal of the American Geriatrics Society, 63(11), 2227–2246.
Parsons, C. (2017). Polypharmacy and inappropriate medication use in patients with dementia: an underresearched problem. Therapeutic Advances in Drug Safety, 8(1), 31–46.
Pickering, G., Gibson, S. J., Serbouti, S., Odetti, P., Gonçalves, J. F., Gambassi, G., … Wary, B. (2010). Reliability study in five languages of the translation of the pain behavioural scale Doloplus®. European Journal of Pain, 14(5), 545.e1-545.e10.
Reed, S. (2010). A Unitary-Caring Conceptual Model for Advanced Practice Nursing in Palliative Care. Holistic Nursing Practice,24(1), 23–34.
Rietjens JAC, Sudore RL, Connolly M, van Delden JJ, Drickamer MA, Droger M, van der Heide A, Heyland DK, Houttekier D, Janssen DJA, Orsi L0, Payne S, Seymour J, Jox RJ, Korfage IJ; European Association for Palliative Care. (2017) Definition and recommendations for advance care planning: an international consensus supported by the European Association for Palliative Care. Lancet Oncol. 2017 Sep;18(9):e543-e551.
Rottenberg, Y., Jacobs, J. M., & Stessman, J. (2015). Prevalence of pain with advancing age brief report. Journal of the American Medical Directors Association, 16(3), 264.e1-264.e5.
Sampson, E. L. Candy, B., Jones, L. (2009). Enteral tube feeding for older people with advanced dementia. Cochrane Database of Systematic Reviews, Apr 15;(2):CD007209.
Sharp, T., Moran, E., Kuhn, I., & Barclay, S. (2013). Do the elderly have a voice? Advance care planning discussions with frail and older individuals: A systematic literature review and narrative synthesis. British Journal of General Practice, 63(615), 657–668.
Singer, P. A., Robertson, G., & Roy, D. J. (1996). Bioethics for clinicians: 6. Advance care planning. Cmaj, 155(12), 1689–1692.
SINPE. (2002). Aspetti bioetici della Nutrizione Artificiale.Rivista Italiana Di Nutrizione Parenterale Ed Enterale, (8), 58–60.
Stein P, Aalboe J. (2015) Dental Care in the Frail Older Adult: Special Considerations and Recommendations. J Calif Dent Assoc. Jul;43(7):363-8
Stone, N. D., Ashraf, M. S., Calder, J., Crnich, C. J., Crossley, K., Drinka, P. J., … Bradley, S. F. (2012). Surveillance Definitions of Infections in Long-Term Care Facilities: Revisiting the McGeer Criteria. Infection Control & Hospital Epidemiology, 33(10), 965–977.
Storti, M. (2009). La validazione di una scala di accertamento del dolore in pazienti con decadimento cognitivo: la scala Abbey nella versione italiana. Recenti Progressi in Medicina, 100(9), 405–409.
Storti, M., Bertozzo, E., Dal Santo, P., Mari, M., Dal Cengio, L., Forni, C., … Zucchi, A. (2014). La misurazione del dolore nel paziente affetto da demenza: Una rassegna degli strumenti più appropriati. Recenti Progressi in Medicina, 105(4), 166–174
Teno, J. M., Gozalo, P. L., Mitchell, S. L., Kuo, S., Rhodes, R. L., Bynum, J. P. W., & Mor, V. (2012). Does feeding tube insertion and its timing improve survival? Journal of the American Geriatrics Society,60(10), 1918–1921.
Threapleton, D. E., Chung, R. Y., Wong, S. Y. S., Wong, E., Chau, P., Woo, J., … Yeoh, E. K. (2017). Integrated care for older populations and its implementation facilitators and barriers: A rapid scoping review. International Journal for Quality in Health Care, 29(3), 327–334.
Van Dalen-Kok, A. H., Pieper, M. J., De Waal, M. W., Lukas, A., Husebo, B. S., & Achterberg, W. P. (2015). Association between pain, neuropsychiatric symptoms, and physical function in dementia: A systematic review and meta-analysis. BMC Geriatrics, 15(1).
Van Der Maaden, T., Van Der Steen, J. T., De Vet, H. C. W., Hertogh, C. M. P. M., & Koopmans, R. T. C. M. (2016). Prospective Observations of Discomfort , Pain , and Dyspnea in Nursing Home Residents With Dementia and Pneumonia. Journal of the American Medical Directors Association, 17(2), 135–135.
Van der Riet,P., Brooks, D., Ashby, M. (2006) Nutrition and hydration at the end of life: pilot study of a palliative care experience. J Law Med 14(2), 182-98. FULL TEST NON DISPONIBILE
Van Der Steen, J. T., Pasman, H. R. W., Ribbe, M. W., Van Der Wal, G., & Onwuteaka-Philipsen, B. D. (2009). Discomfort in dementia patients dying from pneumonia and its relief by antibiotics. Scandinavian Journal of Infectious Diseases, 41(2), 143–151.
Van Der Steen, J. T., Radbruch, L., Hertogh, C. M., De Boer, M. E., Hughes, J. C., Larkin, P., … Volicer, L. (2014). White paper defining optimal palliative care in older people with dementia: A Delphi study and recommendations from the European Association for Palliative Care. Palliative Medicine, 28(3), 197–209.
Venturiero, V., Tarsitani, P., Liperoti, R., Ardito, F., Carbonin, P., Bernabei, R., & Gambassi, G. (2000). Cure palliative nel paziente anziano terminale. Giornale Di Gerontologia, 48(4), 222–246.
Warden V, Hurley AC, Volicer L. (2003) Development and psychometric evaluation of the Pain Assessment in Advanced Dementia (PAINAD) scale. J Am Med Dir Assoc. Jan-Feb;4(1):9-15
World Health Organization. (1998). The world health report 1998: life in the 21st century A vision for all. World Health Organisation, 226.
Wynne, C. F., Ling, S. M., & Remsburg, R. (2000). Comparison of Pain Assessment Instruments. Geriatric Nursing, 21(1), 20–23.
Yates, E., Mitchelle, S. L., Habtemariam, D., Dufour, A. B., & Givens, J. L. (2015). Interventions Associated with the Management of Suspected Infections in Advanced Dementia Elizabeth. J Pain Symptom Manage,50(6), 806–813.
Zwakhalen SM, van der Steen JT, Najim MD. (2012). Which score most likely represents pain on the observational PAINAD pain scale for patients with dementia? J Am Med Dir Assoc. May;13(4):384-9
Ritorna alla scheda informativa della Conferenza di Consenso