Capitolo del Manuale per operatori “educare alla Salute e all’Assistenza”
Autore: Francesco Talarico
- Individuazione precoce delle malattie croniche misconosciute
- Presa di coscienza della condizione patologica individuata e percorso di accettazione
- Elaborazione del profilo clinico-funzionale della persona
- Strutturazione dell’educazione terapeutica nel piano di cura individuale e il patto di cura
- L’intervento educativo: sviluppo delle competenze attese della persona
- Monitorare e sostenere l’aderenza e la persistenza del piano di cura individuale
- Il Percorso Diagnostico-Terapeutico-Assistenziale (PDTA) quale strumento di empowerment per il paziente
- Glossario
- Bibliografia
- Spazio discussione
Individuazione precoce delle malattie croniche misconosciute
L’individuazione precoce delle malattie si avvale come mezzo principale degli interventi di screening.Lo screening è una strategia utilizzata in una popolazione per identificare la possibile presenza di una malattia non ancora diagnosticata in individui senza segni o sintomi di malattia. Questi possono essere individui con una malattia pre-sintomatica o una malattia già sintomatica ma non ancora riconosciuta.
Sebbene gli screening possano condurre alla diagnosi precoce, non tutti i relativi test hanno dimostrato di produrre benefici alle persone sottoposte a screening. Alcuni dei potenziali effetti avversi dello screening sono rappresentati dalla overdiagnosis (quando in soggetti asintomatici viene diagnosticata una malattia che non sarà mai sintomatica, né causa di mortalità precoce), dalle possibili diagnosi errate e dal creare un falso senso di sicurezza. Si è, pertanto, reso necessario, da subito, elaborare dei criteri che fossero adeguati ad un impiego corretto di questo strumento.I criteri di Wilson e Jungner (Wilson, 1968), elaborati sul finire degli anni sessanta, e tuttora attuali, sono considerati i criteri classici ovvero il gold standard della valutazione dello screening:
- La condizione patologica, oggetto dello screening, deve rappresentare un importante problema di salute
- Deve essere disponibile un trattamento efficace per i pazienti nei quali viene individuata la malattia
- Devono esistere adeguate condizioni di accessibilità per la diagnosi ed il trattamento
- Deve essere presente un periodo di latenza abbastanza lungo o uno stadio sintomatico precoce
- Devono essere disponibili test o esami adatti allo scopo
- Il test deve essere accettabile per la popolazione
- La storia naturale della condizione patologica, inclusa la fase che va dallo sviluppo della forma latente alla malattia clinicamente evidente, deve essere oggetto di adeguata comprensione
- Ci deve essere un accordo generale sulle modalità di trattamento dei pazienti
- Il costo di ogni singolo caso individuato, incluso diagnosi e trattamento dei pazienti diagnosticati, deve essere oggetto di adeguata considerazione sul piano economico in relazione alle spese che incidono sull’assistenza medica valutata nel suo complesso
- L’individuazione dei casi deve essere un processo continuo e non un intervento episodico
Successivamente all’emanazione di questi criteri molto è stato scritto per rivalutare i medesimi, anche in virtù del crescente interesse per i test genetici.Al termine di questo processo di revisione sono stati quindi elaborati i nuovi criteri (Andermann, 2008) che integrano i precedenti:
- Il programma di screening deve rispondere ad un bisogno riconosciuto;
- Gli obiettivi dello screening devono essere definiti sin dall’inizio;
- Ci deve essere una popolazione bersaglio ben definita;
- Deve esserci evidenza scientifica dell’efficacia del programma di screening;
- Il programma dovrebbe integrare educazione, effettuazione dei test, servizi clinici e gestione;
- Deve essere disponibile un programma di verifica della qualità con meccanismi tali da minimizzare i potenziali rischi;
- Il programma deve garantire consenso informato, confidenzialità e rispetto dell’autonomia dei soggetti arruolati;
- Il programma deve promuovere equità ed accessibilità per l’intera popolazione bersaglio;
- La valutazione del programma deve essere pianificata dall’inizio;
- I benefici dello screening devono essere superiori ad eventuali rischi.
Il quadro fin qui delineato rende lo screening uno strumento ideale proprio per le malattie croniche. Occorre precisare che gli interventi di screening non vengono considerati diagnostici in quanto spesso presentano tassi significativi sia di falsi negativi che di falsi positivi, pertanto sono sovente necessari i test di conferma.
Alcune campagne di screening hanno avuto un enorme successo nel mondo, rappresentando ormai un riferimento consolidato (ricordiamo, tra gli altri, lo screening del cancro della mammella, della cervice uterina e del colon-retto (cfr. cap. 12) oppure lo screening neonatale di fenilchetonuria e ipotiroidismo). Altre campagne hanno avuto meno successo e sono state messe in discussione (ad es. lo screening del cancro della prostata utilizzando il – Prostate Specific Antigen).In ogni caso è necessario, da parte degli operatori di salute, conoscere opportunità e limiti di questo strumento al fine di presentare in modo scientificamente corretto le possibili opzioni ai pazienti e saperne guidare le scelte.
Presa di coscienza della condizione patologica individuata e percorso di accettazione
Uno degli aspetti più dibattuti dello screening è proprio la comunicazione della diagnosi effettuata. Infatti, comunicare ad un paziente apparentemente in buona salute di essere, in realtà, portatore di una malattia rappresenta non solo una sfida per il medico che deve saper utilizzare la comunicazione con sensibilità e competenza, ma è, soprattutto, fonte di stress per il paziente.
Proprio per tale ragione dagli screening sono state escluse tutte quelle malattie che non hanno possibilità di trattamento poiché, in tal caso, si provocherebbe uno stato di ansia al quale non si potrebbe dare risposta.
Pertanto, effettuata la diagnosi, anche attraverso i necessari test di conferma, deve iniziare immediatamente la presa in carico del paziente da un punto di vista sia medico che psico-relazionale.
In ogni caso, nel momento in cui viene diagnosticata una condizione cronica di malattia inizia un lungo viaggio che non è solo sul piano fisico ma anche sul piano emotivo. Infatti un paziente portatore di una condizione cronica va incontro ad un percorso emotivo complesso ed articolato.
Tale percorso è stato efficacemente rappresentato dai 5 stadi del dispiacere in base al modello inizialmente elaborato da Elisabeth Kübler-Ross, poi successivamente aggiornato dalla stessa autrice (Kübler-Ross, 2007).Il dispiacere si verifica ogni qualvolta sperimentiamo una perdita. Il concetto di perdita ben si adatta alla malattia cronica: il soggetto percepisce una perdita di indipendenza o, perlomeno, di opportunità rispetto al proprio progetto di vita. Sono infatti questi i sentimenti prevalenti all’inizio del percorso di malattia quand’anche poi la malattia, nel concreto, non dovesse determinare le perdite inizialmente temute.Gli stadi dell’elaborazione del dispiacere, in base al modello di Elisabeth Kübler-Ross, sono di seguito presentati:
Negazione
In questo stadio il mondo ci travolge. La vita non ha più senso. Il paziente entra in uno stato di shock e rifiuto della propria condizione, chiedendosi in che modo la sua vita stia per cambiare e come riuscirà a convivere con questi cambiamenti. Shock e rifiuto possono aiutare ad affrontare il problema e rendere possibile la sopravvivenza. Tuttavia questo stadio può essere pericoloso per le persone con una malattia cronica poiché la negazione della propria condizione può determinare l’incapacità di assumere le iniziative necessarie per affrontare il trattamento di cui hanno bisogno.
Rabbia
La rabbia è uno stadio necessario del processo di guarigione. È importante che il paziente avverta la propria rabbia anche se essa può sembrare illimitata ed incoercibile. Più la rabbia viene avvertita, maggiormente essa inizierà a dissiparsi, aumentando così le nostre possibilità di guarigione. La rabbia non ha confini e può estendersi agli amici, ai medici, alla famiglia ed anche a se stessi.
Contrattazione
Questo è lo stadio nel quale il paziente desidera, al di sopra di tutto, di riottenere la vita di prima. Il paziente rimane intrappolato nei “se” e nei “ma”. La colpa è spesso presente nello stadio della contrattazione. “Se soltanto” conduce spesso il paziente a riferire a se stesso la causa di quanto accaduto ed a soffermarsi, quindi, su cosa avrebbe potuto fare per evitare che ciò si verificasse.
Depressione e ansia
Dopo lo stadio della contrattazione la nostra attenzione volge al presente. Un sentimento di vuoto ci accompagna, la malinconia entra nella nostra vita ad un livello molto più alto di quanto potessimo immaginare. Questo stadio depressivo viene avvertito come se dovesse durare per sempre. È importante capire che questa depressione non è segno di una malattia mentale. Invero, essa è la risposta appropriata ad una perdita. Ci ritiriamo dalla vita, perdendoci in una nebbia di intensa tristezza, vagando senza meta in una dimensione introspettiva. Ricevere una diagnosi di una malattia cronica equivale ad una perdita, ovvero la perdita di quello che era il nostro precedente status che può generare anche sentimenti di ansia.
Accettazione
L’accettazione è spesso confusa con la nozione di essere a proprio agio con ciò che è accaduto. Non è questo il caso: molte persone non si sentono affatto a proprio agio dovendo convivere con una malattia per il resto della vita. Questo stadio è piuttosto l’accettazione della realtà della nostra situazione e il riconoscere che la nuova realtà è una dimensione permanente. Impariamo a convivere con essa. Questa è la nuova normalità con la quale convivere. È importante che l’attitudine verso la malattia sia positiva e proattiva. Anche se non abbiamo avuto alcun controllo rispetto all’insorgenza della malattia possiamo gestire come convivere al meglio con essa nel quotidiano, ad esempio assumendo con regolarità i farmaci prescritti, ricercando aiuto quando necessario, praticando attività fisica, cambiando il nostro stile di vita in modo da renderlo maggiormente salutare.
Elaborazione del profilo clinico-funzionale della persona
Un piano di Educazione Terapeutica del Paziente (ETP) affetto da una malattia cronica deve essere considerato nell’accezione più ampia di salute ovvero la tensione verso un pieno benessere fisico, psichico e sociale. Pertanto, un piano di ETP deve prendere in considerazione non solo obiettivi clinici ma anche obiettivi funzionali da raggiungere. Infatti, in base ad una consolidata letteratura scientifica, si è dimostrato che quando le informazioni diagnostiche sono integrate da informazioni sullo stato di funzionamento del paziente (ad es. attività fisiche o intellettive che possono essere svolte o meno) esse diventano sufficienti per predire:
- la tipologia di servizi ed il livello di intensità assistenziale necessario per corrispondere ai bisogni della persona
- quali corsi di formazione o addestramento sono richiesti per recuperare competenze o acquisirne di nuove
- le tipologie di aiuto necessarie per riprendere il lavoro e recuperare l’integrazione sociale
- l’entità di eventuali sussidi economici (ad es. pensioni di invalidità, indennità di accompagnamento).
Pertanto, nel caso delle malattie croniche, una volta pervenuti ad una diagnosi clinica abbiamo solo completato una parte dell’opera che ci attende. La diagnosi in senso clinico è, ovviamente, necessaria in quanto consente di avere indicazioni sulla prognosi quoad vitam e quoad valetudinem e permette, soprattutto, di avere accesso alle terapie appropriate di cui il paziente ha bisogno. Tuttavia la convivenza con la malattia cronica, per quanto espresso in premessa, pone l’esigenza imprescindibile di affiancare alla diagnosi clinica l’inquadramento funzionale.
Diagnosi clinica e diagnosi funzionale sono distinte ma complementari e rispondono a due differenti classificazioni di cui l’Organizzazione Mondiale della Sanità si è dotata per una esaustiva descrizione del fenomeno salute: l’ICD-10 (OMS, 1990), anche se in Italia si usa ancora l’ICD 9-CM (ISTAT, 2007), e l’ICF (OMS, 2004). L’ICD-10 definisce e descrive le malattie o altre condizioni di salute in termini di sintomi, segni ed altri indicatori, la cui combinazione viene utilizzata per pervenire alla diagnosi clinica. L’ICF, invece, classifica il funzionamento umano, includendo le funzioni corporee, e fornisce un modello per descrivere i livelli dei problemi nelle funzioni corporee, ovvero le menomazioni, a prescindere dall’eziologia. Le funzioni corporee/menomazioni sono inserite nella più ampia descrizione del funzionamento e della disabilità che include attività e partecipazione, ivi compresi i problemi relativi a limitazioni di attività o restrizioni della partecipazione. Tutte e due sono classificazioni e, in quanto tali, sono rivolte alla generalità dell’universo salute. Per la comprensione di specifici fenomeni patologici sono necessari strumenti particolari.
Dalle classificazioni delle malattie sono nati diversi algoritmi che vengono correntemente utilizzati per la diagnosi di specifiche malattie (ad es. Framingham Heart Study Criteria per la diagnosi dello scompenso cardiaco). Anche in campo funzionale esistono numerosi strumenti specifici, alcuni preesistenti al lancio dell’ICF (scala FIM – Functional Independence Measure per la valutazione dell’indipendenza funzionale, SF-36 – Short Form 36 Health Survey per la valutazione della qualità di vita, etc), altri da essa derivati (WHO-DAS 2.0 per la valutazione dell’autonomia funzionale).
La valutazione funzionale può essere eseguita con specifici strumenti rispetto a numerosi ambiti, tra i quali si segnalano, a titolo esemplificativo, i seguenti:
- Qualità di vita;
- Disabilità;
- Rischio Cadute;
- Rischio Piaghe da Decubito;
- Stato nutrizionale;
- Depressione;
- Stato Cognitivo;
- Dolore;
- Specifiche condizioni morbose;
- Comorbidità;
- Valutazione Multi-Dimensionale
Il quadro è molto ampio e variegato: di volta in volta verranno selezionati quegli strumenti più adeguati a descrivere la specifica esperienza di salute della persona affetta da una condizione cronica di malattia. Pertanto l’uso combinato di tali strumenti deve essere propedeutico allo sviluppo di un programma di ET.
Strutturazione dell’educazione terapeutica nel piano di cura individuale e il patto di cura
In base alla definizione dell’OMS (WHO, 1998) un programma di Educazione Terapeutica del Paziente (TPE – Therapeutic Patient Education) aiuta i pazienti ad acquisire o mantenere le competenze di cui hanno bisogno per gestire la propria vita con una malattia cronica nel miglior modo possibile. Rappresenta un elemento basilare nell’ambito della gestione complessiva del paziente. Essa riguarda attività organizzate, includenti il supporto psicosociale, progettate per rendere il paziente totalmente consapevole della propria malattia informandolo sulle cure ed i comportamenti correlati alla salute e alla malattia. La semplice offerta di informazioni orali o scritte, oppure consigli riguardanti la prevenzione non costituiscono un programma di ETP.Un programma di ETP aiuta a migliorare la salute del paziente, definita sia in base a standard clinico-laboratoristici che in termini di indicatori di qualità di vita ed autonomie funzionali.
Gli obiettivi della ETP (WHO, 1998) sono:
- l’acquisizione e il mantenimento di competenze di autogestione della malattia (self-care skills), includendo anche le competenze salvavita. Le competenze di autogestione della malattia sono le decisioni che il paziente prende al fine di modificare l’impatto della malattia sulla propria salute.
- Mobilitazione ed acquisizione delle competenze per la vita (life skills). Esse sono una gamma di abilità cognitive, emotive e relazionali di base, sia personali che interpersonali, che aiutano le persone ad affrontare e gestire la propria vita e permettono loro anche di adattarsi ai cambiamenti dell’ambiente circostante.
Un programma di ETP può essere suddiviso in quattro stadi (HAS, 2007):
- Effettuare una diagnosi educativa;
- Stabilire un programma individualizzato per il paziente con indicazione delle priorità di apprendimento;
- Pianificare ed implementare le sessioni di TPE sia di gruppo che individuali;
- Valutare le competenze acquisite e, nel caso, revisionare il programma.
Diagnosi educativa
L’obiettivo deve essere quello di conoscere i nostri pazienti e stabilire i loro bisogni, aspettative e capacità ricettive (HAS, 2007).
- Scoprire, con un’intervista strutturata, ciò che il paziente conosce, le sue idee, le spiegazioni che si da e i sentimenti che manifesta:
- verificare ciò che il paziente sa, oppure quello in cui crede riguardo le modalità di gestione della propria condizione;
- valutare cosa conosce della propria malattia e della sua insorgenza: cause, progressione e severità;
- accertare le condizioni di vita e lavorative;
- valutare il know-how del paziente: capacità di autogestione della malattia, uso dei farmaci, dieta.
- Esaminare le reazioni psicologiche del paziente alle situazioni nelle quali è coinvolto:
- identificare le reazioni individuali di ogni paziente: i loro comportamenti (per esempio la ricerca di informazioni, le richieste di aiuto), il livello cognitivo (capacità di valutare la propria situazione) e lo stato emotivo (paura rabbia, ansia);
- identificare la percezione e la valutazione da parte del paziente dello stress e dei fattori di vulnerabilità nonché delle risorse sociali di cui può disporre o meno (reti sociali, grado di isolamento, problemi relazionali);
- rilevare i fattori di fragilità dovuti all’età che avanza.
- Identificare ogni fattore socio-ambientale positivo o negativo (background sociale, età e stile di vita), caratteristiche sociali e culturali, eventi di vita stressanti e problemi sociali, difficoltà di integrazione:
- determinare quali fattori il paziente percepisce come punti di forza (ad es. ottimismo, sensazione di avere il controllo della situazione, auto-efficienza) o debolezza (ansia, scarsa autostima, depressione);
- stabilire bisogni, aspettative, credenze e paure;
- stabilire con il paziente i fattori che ostacolano o facilitano l’acquisizione di competenze di autogestione della malattia, l’implementazione del suo progetto di vita, la mobilitazione o l’acquisizione delle life skills;
- identificare situazione di instabilità o rischio sociale.
- Scoprire cosa il paziente conosce riguardo la propria salute e cosa si aspetta; identificare ogni difficoltà di apprendimento:
- stabilire con il paziente come integrare la TPE nella strategia assistenziale complessiva;
- verificare l’esistenza di problemi di lettura o di comprensione, ogni disabilità sensoriale o mentale, deficit cognitivo, dislessia, etc.
- Incoraggiare l’auto-motivazione del paziente; stabilire con il paziente le modalità di auto-gestione della malattia a lui più confacenti:
- tenere conto dei suoi desideri e progetti;
- stabilire l’ordine sia delle nozioni da apprendere che dei cambiamenti da effettuare, negoziando le priorità con il paziente;
- incoraggiare le pratiche di autovalutazione che sono soddisfacenti per il paziente.
Sessioni di educazione terapeutica
A titolo di esempio un programma di TPE può includere una sessione di diagnosi educazionale, almeno due sessioni individuali o collettive di ET condotte a distanza di un mese l’una dall’altra, e una sessione di revisione dopo sei mesi (Barbarot, 2010).Una volta effettuata la diagnosi educazionale è possibile programmare le sessioni di ET. Esse sono rappresentate da incontri per acquisire e condividere la conoscenza della propria condizione di salute e malattia. Le sessioni possono essere divise in moduli:
- modulo 1 – Come affrontare la malattia nella quotidianità
- modulo 2 – Comprendere la malattia
- modulo 3 – Comprendere i trattamenti
- modulo 4 – Comprendere i fattori aggravanti della malattia
- modulo 5 – Conoscere come adattare il trattamento alla malattia
- modulo 6 – Comprendere come adattare il proprio stile di vita ai cambiamenti imposti dalla malattia
Le sessioni possono essere individuali o collettive. Dopo la diagnosi educazionale il paziente sceglie di seguire un programma composto di sessioni individuali, collettive o combinate. Le sessioni collettive favoriscono lo scambio di esperienze e conoscenze tra i pazienti: devono essere guidate da almeno due operatori sanitari appositamente formati. La leadership è multidisciplinare (medici, psicologi, infermieri, etc.). Le sessioni individuali sono più semplici da organizzare e sono appropriate per pazienti che sono reticenti a partecipare alle sessioni collettive.
L’intervento educativo: sviluppo delle competenze attese della persona
Self-care skills
- Contenere la sintomatologia;
- Tenere in considerazione i risultati di auto-monitoraggio e di auto-misurazione:
- Adattare le dosi di farmaci, iniziando l’auto trattamento;
- Effettuare procedure sanitarie;
- Attuare i cambiamenti di stile di vita (ad es. dieta ed esercizio);
- Prevenire le complicanze evitabili;
- Affrontare i problemi correlati alla malattia;
- Coinvolgere i parenti stretti e gli amici nella gestione della malattia e del trattamento ed in ogni altra ripercussione
Life skills
- Sviluppare auto-consapevolezza e fiducia in se stessi;
- Gestire le emozioni e controllare lo stress;
- Sviluppare il ragionamento creativo ed il pensiero critico;
- Rafforzare la comunicazione e le competenze interpersonali;
- Promuovere la capacità di prendere decisioni e di risolvere i problemi;
- Definire obiettivi ed effettuare scelte;
- Auto-esame, auto-valutazione ed auto-rinforzo.
Una puntuale declinazione delle competenze attese viene presentata nella tabella 1.
| Competenze | Esempi di obiettivi |
| Comprendere e spiegare | Comprendere il corpo umano, la malattia, la sua fisiopatologia, le ripercussioni familiari e sociali ed i principi sottostanti il trattamento |
| Identificare, analizzare, misurare* | Identificare segnali di avvertimento dei sintomi precoci, analizzare una situazione di rischio ed i risultati di un test, essere capace di misurare il glucosio, la pressione sanguigna, il picco di flusso, etc. |
| Affrontare, decidere | Conoscere come affrontare una crisi (per esempio ipoglicemia, iperglicemia, attacchi di asma, come decidere in emergenza etc.) |
| Risolvere i problemi (trattamenti giornalieri, gestione della malattia, prevenzione) | Essere capaci di adattare i trattamenti (ad es. le dosi di insulina), bilanciare la dieta nell’ambito della giornata o della settimana, prevenire gli incidenti e le esacerbazioni, implementare uno stile di vita ed un ambiente che sia di supporto alla salute (ad es. attività fisica e gestione dello stress) |
| Effettuare, mettere in opera* | Essere capaci di praticare procedure tecniche (ad es. iniezioni di insulina, auto-monitoraggio del glucosio ematico, uso di sprays o dispositivi di inalazione, misurazione del picco di flusso) ed auto-esame (ad es. respiro, edema, polsi e procedure di emergenza) |
| Adattare, modulare | Essere capace di adattare il trattamento al contesto (viaggi, sport, gravidanza), modulare il trattamento o la dieta ed adottare nuove tecnologie mediche |
| Utilizzare le risorse del sistema sanitario. Esercitare I propri diritti | Conoscere dove e quando rivolgersi per una consultazione, chi chiamare, ricercare le informazioni utili; esercitare i propri diritti (scuola, lavoro, etc.), prendere parte nelle associazioni dei pazienti etc. |
* queste competenze includono anche le procedure salva-vita
Monitorare e sostenere l’aderenza e la persistenza del piano di cura individuale
L’ETP è un processo permanente integrato nel trattamento. I programmi possono essere rinnovati in base al follow-up del paziente.Il monitoraggio deve essere effettuato congiuntamente con il paziente anche attraverso lo sviluppo delle competenze di autovalutazione (HAS, 2007).
Un programma di monitoraggio deve:
- Consentire al paziente di esprimere il proprio punto di vista riguardo il processo educativo e la sua organizzazione con particolare riguardo a:
- implementazione e contenuti del programma di ETP, organizzazione (scelta degli spazi e durata delle sessioni), metodi di insegnamento, ricadute nella vita di tutti i giorni;
- relazioni del paziente con i provider assistenziali ed il loro ruolo nel coordinamento delle attività educative.
- Assicurarsi che la diagnosi educativa sia ancora rilevante e che le competenze acquisite siano coerenti con le priorità di apprendimento ponendosi le seguenti domande:
- La diagnosi educativa ha evidenziato gli items rilevanti?
- Le competenze da acquisire sono state definite in modo preciso, chiaro e realistico?
- I nuovi dati sono stati tenuti in considerazione?
- I contenuti delle sessioni di ETP sono stati rilevanti e sufficientemente ben sviluppati?
- È stato realizzato l’adattamento dei metodi educativi alle necessità di acquisizione delle competenze richieste?
- Le competenze acquisite dal paziente sono coerenti con le finalità di apprendimento, con il modo di affrontare la propria malattia e con i cambiamenti nella vita di tutti i giorni?
- Permettere al paziente di esprimere la propria esperienza di malattia cronica ed il modo di gestirla nel quotidiano con particolare riguardo a:
- i sentimenti del paziente riguardo i benefici della ETP, i cambiamenti effettuati, il soddisfacimento dei bisogni, la sua autonomia e percezione del rischio;
- l’esperienza correlata al supporto fornito dai parenti ed alle pressioni sociali e ambientali;
- la reazione agli incidenti ed il progetto di vita;
- benessere e qualità di vita: salute fisica (faticabilità, dolore, sonno) fattori psicologici (immagine corporea positiva o negativa, autostima, vissuto) grado di indipendenza (ad es. attività di vita quotidiana, capacità lavorativa) relazioni sociali (ad es. relazioni interpersonali, concreto supporto sociale, attività sessuale) ambiente (ad es. risorse, sicurezza, attività del tempo libero) convinzioni personali e spiritualità (ad es. significato della vita, credenze).
Da tale azione di monitoraggio discende l’aggiornamento del programma di ETP che si porrà, di volta in volta, obiettivi che siano confacenti non solo allo stato della malattia ma anche al grado di maturazione educativa raggiunto dal paziente. Un importante ambito applicativo dell’ETP è rappresentato dal Percorso Diagnostico-Terapeutico-Assistenziale (PDTA) al quale viene dedicata una specifica trattazione.
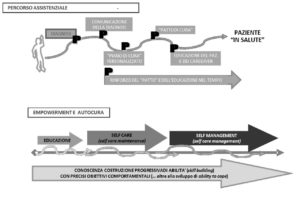
Il Percorso Diagnostico-Terapeutico-Assistenziale (PDTA) quale strumento di empowerment per il pazienteL’autrice del paragrafo è Anna Maria Renda. I nuovi scenari demografici e la necessità di garantire la sostenibilità economica del Sistema Sanitario determinano l’esigenza di inserire il cittadino al centro di un PDTA di cui viene garantita la continuità delle cure anche se parti di questo processo possono essere svolte in luoghi diversi, da professionisti diversi e in tempi diversi (Caccia, 2008). L’approccio per PDTA consente la valutazione di consumi (farmaci, accertamenti diagnostici, visite, prestazioni socioassistenziali), di costi e di risultati (ASIS, 2015). Sulla base di un consensus meeting internazionale tenutosi in Slovenia (Dicembre 2005), la definizione di PDTA accettata dall’European Pathway Association è la seguente: “I PDTA sono una metodologia mirata alla condivisione dei processi decisionali e dell’organizzazione dell’assistenza per un gruppo specifico di pazienti durante un periodo di tempo ben definito” (http://e-p-a.org/). L’OMS definisce l’empowerment come “Un processo dell’azione sociale attraverso il quale le persone, le organizzazioni e le comunità acquisiscono competenza sulle proprie vite, al fine di cambiare il proprio ambiente sociale e politico per migliorare l’equità e la qualità di vita” (ARESS, 2007). Nella parte bassa della figura che segue, estratta dal Piano Nazionale della Cronicità, viene messa in evidenza la necessità di differenziare e personalizzare anche le modalità di “Educazione”, intesa come addestramento del paziente, che deve adattarsi alle caratteristiche (limiti/potenzialità) del paziente stesso e svilupparsi evolutivamente nel tempo mano a mano che questi acquisisce maggiori competenze ed autonomia. Figura 1: Percorsi Assistenziali strumenti di empowerment
Rispetto all’efficacia del processo educativo va segnalata la tendenza dei sistemi più avanzati a “desanitarizzare” quest’area, evitando di perseguire gli eccessi specialistici della conoscenza e ricorrendo ad attori potenzialmente più empatici e più comunicativi. Fondamentale, quindi, in quest’area il ruolo dei pazienti-esperti, capaci di condividere e trasmettere anche il proprio “vissuto”, così come importante è il ruolo del “volontariato esperto”, annoverato nell’ampia area di esperienze che fa capo all’autogestione promossa attraverso personale “laico”, non professionista (“Lay-led Self Management”). Si va, in conclusione, verso l’idea di un “paziente con patologia cronica in salute”, intendendo con tale formula non soltanto l’assenza di complicanze e di malessere ma anche una maniera quanto più “salutare” possibile di convivere con la propria patologia, che costituisce la base fondamentale del processo di empowerment. (Ministero della Salute, 2016) Nella pratica prendiamo ad esempio quanto proposto nel modello dei PDTA della Regione Lazio nel quale la centralità del paziente e la sua partecipazione attiva e responsabile al processo di cura è un aspetto trasversale che:
Se passiamo ora ai risultati della nostra analisi sul ruolo dei PDTA nell’empowerment, osserviamo che nei PDTA dello “scompenso cardiaco” l’obiettivo di salute prevede di offrire una migliore assistenza ai pazienti, attivando tutte le risorse della comunità (volontariato, gruppi di auto-aiuto, associazioni pubbliche, etc.) per aiutare il paziente a diventare protagonista attivo dei processi assistenziali. Negli obiettivi organizzativi si prevede, fra gli altri, educazione sanitaria di gruppo per i pazienti e i loro familiari, in particolare orientata alla promozione di corretti stili di vita, alimentazione e aderenza alla terapia, educazione all’autocontrollo dei parametri di pressione arteriosa, frequenza cardiaca e peso. Quanto sopra ci sembra in perfetta analogia con il Programma di supporto all’autogestione del paziente, ideato da Kate Lorig presso l’Università di Stanford e diffuso in numerosi sistemi sanitari occidentali che prevede:
Il paradigma della relazione mira a sviluppare l’empowerment dell’assistito il quale, acquisendo una profonda conoscenza e consapevolezza di sé e dei propri bisogni di salute, assume la responsabilità della gestione del proprio percorso all’interno dell’organizzazione sociosanitaria ed è incoraggiato e motivato a sviluppare un’autogestione completa – self-management – delle proprie criticità, avvalendosi della consulenza educativa del professionista della salute spesso rappresentato dall’infermiere.(Bodenheimer, 2002) Analogamente, nei PDTA dedicati ad un’altra patologia cronica come la BPCO, viene promosso l’empowerment del paziente, ossia il suo coinvolgimento diretto nella gestione della propria salute, attraverso i rapporti con i familiari e con le associazioni dei pazienti (Sole 24 ore Sanità, 2015). Nel caso delle malattie rare, in cui i PDTA si sono triplicati negli ultimi anni, le associazioni di pazienti affetti da malattie rare ed i loro familiari potrebbero quasi considerarsi un modello esemplificativo del sostanziale ruolo che organizzazioni di questo tipo svolgono nel promuovere la responsabilizzazione e la partecipazione attiva nelle politiche sanitarie del paziente stesso. Per raggiungere questo tipo di compartecipazione è necessario, però, sviluppare un senso di comunità e la capacità di organizzazione di azioni collettive (Aymé, 2008). I malati rari, d’altro canto, devono confrontarsi quotidianamente non solo con gli aspetti clinici della loro condizione, ma anche gli aspetti sociali, relazionali e psicologici ad essa correlati, che influiscono pesantemente sulla qualità della loro vita e di quella del loro nucleo familiare. Per questo le associazioni di pazienti con malattia rara sono tra i gruppi più attenti all’empowerment (soprattutto nel settore sanitario), proprio per la natura stessa delle loro patologie, ancora così poco conosciute, con forte ritardo diagnostico e con poche terapie/trattamenti disponibili (Ministero della Salute, 2001). Le associazioni, giocano un ruolo importante nel rapporto con le istituzioni sanitarie, promuovendo lo sviluppo di un sistema sanitario centrato sul paziente. Il loro rafforzamento, infatti, produce un duplice frutto:
La partecipazione attiva dei soggetti coinvolti nelle scelte dei percorsi di diagnosi e cura è un elemento imprescindibile della medicina contemporanea. A partire da questo presupposto il vissuto del paziente e di chi se ne prende cura diventa centrale per costruire un percorso personalizzato e condiviso. Fra gli strumenti che il Centro Nazionale Malattie Rare ha utilizzato per promuovere la partecipazione attiva dei pazienti e migliorare il funzionamento dell’intero team di cura, attraverso la consapevolezza del ruolo professionale e del mondo emotivo di ciascun operatore, c’è la medicina narrativa. L’ascolto del paziente promuove la fiducia e rinforza l’alleanza terapeutica, contribuendo a diminuire le cosiddette pratiche di medicina difensiva e lasciando spazio alla relazione, che diventa uno strumento di comprensione della diagnosi e della cura (Centro Nazionale Malattie Rare, 2015). Il vissuto del paziente, l’“illness”, e la percezione sociale della malattia, la “sickness”, sono necessariamente complementari alle conoscenze cliniche del medico, alla malattia intesa, in termini bio-medici, come “disease”. La medicina narrativa può essere uno strumento utile per pensare e affrontare le malattie considerandone questi tre aspetti e ben si colloca nell’ambito di un “approccio globale” di Sanità Pubblica in grado di rispondere ai bisogni delle persone con malattie rare. |
Glossario
- BPCO: Broncopneumopatia Cronica Ostruttiva
- ETP: Educazione Terapeutica del Paziente (Therapeutic Patient Education)
- ICD: International Classification of Diseases
- ICF: International Classification of Functioning, Disabilities and Health
- OMS: Organizzazione Mondiale della Sanità) – WHO (World Health Organization
- PDTA: Percorso Diagnostico Terapeutico Assistenziale
- WHO-DAS: World Health Organization – Disability Assessment Schedule
Bibliografia
- Andermann A, Beauchamp S, Costea I, Blancquaert I, Dery V. (2008). Guiding policy decisions for population-based genetic screening: an evidence-based and interdisciplinary approach. Bulletin World Health Organization 86(4): 317–319
- ARESS (2007). Raccomandazioni per la costruzione di PDTA e PIC nelle Aziende sanitarie della Regione Piemonte
- ASIS (2015). Innovazione Digitale a supporto dei Percorsi Diagnostico Terapeutici Assistenziali
- Aymè S, Kole A,Groft S,et all. Empowerment of patients: lessons from the rare diseases community, Lancet 2008; 371 (9629); 2028-51
- Barbarot S, (2010). Practical guide to therapeutic education. France Therapeutic Education Group (GET), Nantes
- Bodenheimer T, Wagner EH, Grumbach K. (2002). Improving primary care for patients with chronic illness: the chronic care model, JAMA 2002; 288:1909-14
- Caccia C (2008). Management dei sistemi informativi in sanità. McGraw Hill
- Centro Nazionale Malattie rare – Istituto Superiore di Sanità – Laboratorio nazionale di medicina narrativa (2015). Linee di indirizzo per l’utilizzo della Medicina Narrativa in ambito clinico-assistenziale, per le malattie rare e cronico-degenerative
- D’Ivernois JF, Gagnayre R (2001). Mettre en œuvre l’éducation thérapeutique. ADSP (Actualité et dossier en santé publique); 36: 11–13
- HAS. Therapeutic patient education (TPE): definition, goals and organization – quick reference guide (2007). French National Authority for Health (HAS), Paris
- HAS. Therapeutic patient education (TPE): offering and providing TPE – quick reference guide (2007). French National Authority for Health (HAS), Paris
- ISTAT. Classificazione delle Malattie, dei Traumatismi, degli Interventi Chirurgici e delle Procedure Diagnostiche e Terapeutiche (2007), Roma – Edizione Italiana della ICD-9-CM International Classification of Diseases – 9th revision – Clinical Modification (1994) WHO, Geneva
- Kübler-Ross E, Kessler D, (2007). On Grief and Grieving: Finding the Meaning of Grief Through the Five Stages of Loss. Scribner, New York
- Lorig KR, Sobel DS, Ritter PL, Laurent D, Hobbs M. Effect of a self-management program on patients with chronic disease. Eff Clin Pract (2001) 4:256–62
- Ministero della Salute DM 18 marzo 2001,n. 279. Regolamento di istituzione delle Malattie Rare e di esenzione della partecipazione al costo delle relative prestazioni sanitarie per circa 350 MR. GU n. 160, 12 luglio 2001; Suppl. Ord. N. 180/L
- Ministero della Salute, Direzione Generale della Programmazione Sanitaria (2016). Piano Nazionale della Cronicità, “Accordo tra lo Stato, le Regioni e le Province Autonome di Trento e di Bolzano del 15 settembre 2016”
- OMS. Decisions patients make in order to modify the impact of disease on their health (2004). A glossary of terms for community health care and services for older persons. WHO, Centre for Health Development, Kobe
- OMS. ICF – Classificazione Internazionale del Funzionamento, della Disabilità e della salute (2004). Erickson, Trento – Edizione Italiana di ICF – International Classification of Functioning, Disabilities and Health (2001) WHO, Geneva
- OMS. International Classification of Diseases and Related Health Problems 10th revision (1990) WHO, Geneva
- OMS. Therapeutic Patient Education – Continuing Education Programs for Health Care Providers in the Field of Prevention of Chronic Diseases (1998). WHO Regional Office for Europe, Copenhagen
- Presa in carico del paziente con patologia respiratoria cronica nel nuovo modello delle cure primarie ex d.l. 158/2012 “Decreto Balduzzi”. Supplemento a il Sole 24 ore Sanità Maggio 2015
- Wilson JMG, Jungner G (1968). Principles and practice of screening for disease. WHO, Geneva